题目内容
镍(Ni)与铁性质相似,属于中等活泼的金属.与酸反应通常生成Ni2+,且Ni2+不宜被氧化,Ni(OH)2难溶于水.某硬化油厂含镍废催化剂主要含有Ni,还含有少量Al、Fe等元素的单质及氧化物、其他不溶性杂质.从其中回收镍的流程如图:

部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
回答下列问题:
(1)“碱浸”的目的是除去 ,“酸浸”所加入的酸液是 .
(2)加入H2O2的目的是 ,检验该目的是否达到的实验操作及现象是:取少量保温氧化后的溶液于试管中, .
(3)“调pH为2~3”的目的是 .

部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)“碱浸”的目的是除去
(2)加入H2O2的目的是
(3)“调pH为2~3”的目的是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:从含镍废催化剂回收镍的流程为:废镍催化剂先用碱液洗涤,铝是两性元素和强碱反应,氧化铝是两性氧化物和强碱反应,镍单质和铁及其氧化物不和碱反应,可以达到除去铝元素的目的,同时除去表面的油污,过滤,滤液为AlO2-,滤渣为镍金属和铁单质及其氧化物,“酸浸”将滤渣溶解,制备目的是得到NiSO4?7H2O,加入的酸不能引入新的杂质,所以需要加入硫酸进行酸浸,过滤滤渣为其他不溶性杂质,滤液为Ni2+、SO42-、Fe2+,亚铁离子和双氧水反应生成铁离子,所以加入H2O2,硫酸亚铁被双氧水氧化生成Fe2(SO4)3,2Fe 2++H2O2+2H+=2Fe 3++2H2O,保温氧化0.5h,使其充分氧化,调节PH=5.5,形成氢氧化铁沉淀,过滤,调节PH=2~3,防止在浓缩结晶过程中Ni2+水解,浓缩得到NiSO4?7H2O.
(1)含镍催化剂主要含有Ni,还含有Al的单质及氧化物,铝和氧化铝都可以和强酸强碱反应溶解得到溶液含有偏铝酸盐,同时碱液除去表面的油污;依据最后制备NiSO4?7H2O,防止引入其它杂质离子需要加入硫酸进行溶解;
(2)加入硫酸进行酸浸,过滤滤渣为其它不溶性杂质,滤液为Ni2+、SO42-、Fe2+,亚铁离子和双氧水反应生成铁离子,调节PH=5.5,形成氢氧化铁沉淀;检验铁离子中是否含有亚铁离子用铁氰化钾;
(3)调节溶液PH为酸性防止镍离子水解,减少镍离子的损失.
(1)含镍催化剂主要含有Ni,还含有Al的单质及氧化物,铝和氧化铝都可以和强酸强碱反应溶解得到溶液含有偏铝酸盐,同时碱液除去表面的油污;依据最后制备NiSO4?7H2O,防止引入其它杂质离子需要加入硫酸进行溶解;
(2)加入硫酸进行酸浸,过滤滤渣为其它不溶性杂质,滤液为Ni2+、SO42-、Fe2+,亚铁离子和双氧水反应生成铁离子,调节PH=5.5,形成氢氧化铁沉淀;检验铁离子中是否含有亚铁离子用铁氰化钾;
(3)调节溶液PH为酸性防止镍离子水解,减少镍离子的损失.
解答:
解:从含镍废催化剂回收镍的流程为:废镍催化剂先用碱液洗涤,铝是两性元素和强碱反应,氧化铝是两性氧化物和强碱反应,镍单质和铁及其氧化物不和碱反应,可以达到除去铝元素的目的,同时除去表面的油污,过滤,滤液为AlO2-,滤渣为镍金属和铁单质及其氧化物,“酸浸”将滤渣溶解,制备目的是得到NiSO4?7H2O,加入的酸不能引入新的杂质,所以需要加入硫酸进行酸浸,过滤滤渣为其他不溶性杂质,滤液为Ni2+、SO42-、Fe2+,亚铁离子和双氧水反应生成铁离子,所以加入H2O2,硫酸亚铁被双氧水氧化生成Fe2(SO4)3,2Fe 2++H2O2+2H+=2Fe 3++2H2O,保温氧化0.5h,使其充分氧化,调节PH=5.5,形成氢氧化铁沉淀,过滤,调节PH=2~3,防止在浓缩结晶过程中Ni2+水解,浓缩得到NiSO4?7H2O.
(1)“碱浸”过程中是为了除去铝及其氧化物及其油脂,铝是两性元素和强碱反应,氧化铝是两性氧化物和强碱反应,镍单质和铁及其氧化物不和碱反应达到除去铝元素的目的;反应的两种方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O,),油污在碱液中水解生成易溶的物质,所以可同时除去表面的油污;“酸浸”时主要是溶解镍金属和铁单质及其氧化物,依据制备目的是得到NiSO4?7H2O,加入的酸不能引入新的杂质,所以需要加入硫酸进行酸浸;
故答案为:Al、Al2O3、油脂;H2SO4;
(2)加入硫酸进行酸浸,过滤滤渣为其它不溶性杂质,滤液为Ni2+、SO42-、Fe2+,亚铁离子和双氧水反应生成铁离子2Fe 2++H2O2+2H+=2Fe 3++2H2O,保温氧化0.5h,使其充分氧化,调节PH=5.5,形成氢氧化铁沉淀,除去杂质离子铁离子;检验铁离子中是否含有亚铁离子用铁氰化钾K3[Fe(CN)6],取少量保温氧化后的溶液于试管中,若有蓝色沉淀证明有亚铁离子,反之达到,
故答案为:加入铁氰化钾,若有蓝色沉淀证明有亚铁离子,将亚铁离子氧化为铁离子目的未达到,反之达到;
(3)硫酸镍溶液需要蒸发浓缩结晶析出,为防止镍离子水解生成氢氧化镍沉淀,需要控制溶液pH在酸性条件下,
故答案为:防止在浓缩结晶过程中Ni2+水解.
(1)“碱浸”过程中是为了除去铝及其氧化物及其油脂,铝是两性元素和强碱反应,氧化铝是两性氧化物和强碱反应,镍单质和铁及其氧化物不和碱反应达到除去铝元素的目的;反应的两种方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O,),油污在碱液中水解生成易溶的物质,所以可同时除去表面的油污;“酸浸”时主要是溶解镍金属和铁单质及其氧化物,依据制备目的是得到NiSO4?7H2O,加入的酸不能引入新的杂质,所以需要加入硫酸进行酸浸;
故答案为:Al、Al2O3、油脂;H2SO4;
(2)加入硫酸进行酸浸,过滤滤渣为其它不溶性杂质,滤液为Ni2+、SO42-、Fe2+,亚铁离子和双氧水反应生成铁离子2Fe 2++H2O2+2H+=2Fe 3++2H2O,保温氧化0.5h,使其充分氧化,调节PH=5.5,形成氢氧化铁沉淀,除去杂质离子铁离子;检验铁离子中是否含有亚铁离子用铁氰化钾K3[Fe(CN)6],取少量保温氧化后的溶液于试管中,若有蓝色沉淀证明有亚铁离子,反之达到,
故答案为:加入铁氰化钾,若有蓝色沉淀证明有亚铁离子,将亚铁离子氧化为铁离子目的未达到,反之达到;
(3)硫酸镍溶液需要蒸发浓缩结晶析出,为防止镍离子水解生成氢氧化镍沉淀,需要控制溶液pH在酸性条件下,
故答案为:防止在浓缩结晶过程中Ni2+水解.
点评:本题考查了物质分离的实验设计和方法应用,主要是利用溶液不同PH条件下离子沉淀的情况不同,控制溶液PH除去杂质离子,得到较纯净的硫酸镍溶液来制备硫酸镍晶体,同时考查了除杂原则不能引入新的杂质、铝及其化合物性质分析判断,题目难度中等.

练习册系列答案
相关题目
下列实验方法或操作正确的是( )
| A、将空气通过灼热的铜网可以除去O2 |
| B、用点燃的方法可以除去CO2中的CO |
| C、pH试纸使用前,先用蒸馏水湿润,再测定未知溶液的pH |
| D、稀释浓硫酸时,向浓硫酸中缓缓加入蒸馏水,用玻璃棒搅拌 |
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如下图所示.Z元素原子核外K层与M层电子数相等.下列说法中正确的( )
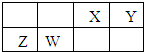

| A、Y元素最高价氧化物对应的水化物化学式为H3YO4 |
| B、原子半径由小到大的顺序为:X<Z<Y<W |
| C、与同浓度的盐酸反应,Z比W更剧烈 |
| D、W的金属性比Z的强 |