题目内容
某科研小组在900℃的空气中合成出化学式为La2Ca2MnOx的超导体材料,其中La以+3价存在.为确定x的值,进行如下分析:
步骤1:准确称取0.5250g超导体材料样品,放入锥形瓶中,加25.00mL0.06000mol?L-1 Na2C2O4溶液(过量)和25mL 6mol?L-1 HNO3溶液,在60-70℃下充分摇动,约半小时后得到无色透明溶液A(该条件下,只有Mn元素被还原为Mn2+,Na2C2O4被氧化为CO2).
步骤2:用0.02000mol?L-1 KMnO4溶液滴定溶液A至终点,消耗10.00mL KMnO4溶液.
(1)步骤1反应后溶液中Mn2+的物质的量浓度为0.02000mol?L-1.常温下,为防止Mn2+形成Mn(OH)2沉淀,溶液的pH的范围为 [已知Mn(OH)2的Ksp=2.0×10-13].
(2)步骤2滴定终点的现象是 .
(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则所测x的值将 (填“偏大”、“偏小”或“不变”).
(4)求x的值(写出计算过程).
步骤1:准确称取0.5250g超导体材料样品,放入锥形瓶中,加25.00mL0.06000mol?L-1 Na2C2O4溶液(过量)和25mL 6mol?L-1 HNO3溶液,在60-70℃下充分摇动,约半小时后得到无色透明溶液A(该条件下,只有Mn元素被还原为Mn2+,Na2C2O4被氧化为CO2).
步骤2:用0.02000mol?L-1 KMnO4溶液滴定溶液A至终点,消耗10.00mL KMnO4溶液.
(1)步骤1反应后溶液中Mn2+的物质的量浓度为0.02000mol?L-1.常温下,为防止Mn2+形成Mn(OH)2沉淀,溶液的pH的范围为
(2)步骤2滴定终点的现象是
(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则所测x的值将
(4)求x的值(写出计算过程).
考点:中和滴定,探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据溶度积常数计算pH的范围;
(2)滴定终点时,显示高锰酸钾溶液的颜色;
(3)滴定终点俯视,读数偏小,根据此计算的和高锰酸钾反应的C2O42-偏少,则溶解消耗的C2O42-偏大,据此分析;
(4)根据消耗高锰酸钾的量计算出和高锰酸钾反应的C2O42-,进而计算出溶解样品所消耗的C2O42-,样品和C2O42-反应时,Mn元素化合价降低得电子,C的化合价升高失电子,根据氧化还原反应中转移电子数相等来计算x值.
(2)滴定终点时,显示高锰酸钾溶液的颜色;
(3)滴定终点俯视,读数偏小,根据此计算的和高锰酸钾反应的C2O42-偏少,则溶解消耗的C2O42-偏大,据此分析;
(4)根据消耗高锰酸钾的量计算出和高锰酸钾反应的C2O42-,进而计算出溶解样品所消耗的C2O42-,样品和C2O42-反应时,Mn元素化合价降低得电子,C的化合价升高失电子,根据氧化还原反应中转移电子数相等来计算x值.
解答:
解:(1)沉淀溶解平衡常数Ksp=c(Mn2+)?c2(OH- ),当c(Mn2+)=0.02000 mol?L-1,所以要防止溶液中Mn2+形成Mn(OH)2沉淀,c(OH- )≤
=
×10-6,c(H+)=
=
,pH=8.5,故pH≤8.5无沉淀生成,故答案为:pH≤8.5;
(2)当滴定终点时,C2O42-被滴定完毕,再加入高锰酸钾,显示高锰酸钾的颜色,故答案为:溶液变成浅红色,且半分钟内不褪色;
(3)滴定终点俯视,读数偏小,根据此计算的和高锰酸钾反应的C2O42-偏少,则溶解消耗的C2O42-偏大,故测量x值偏大;故答案为:偏大;
(3)样品溶解后,滴定消耗高锰酸钾:10.00mL×0.02000mol/L=0.2000mmol,
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
O.2000mmol 0.5000mmol
样品溶解过程所消耗的C2O42-量:25.00mL×0.06000mol/L-0.5000mmol=1.000mmol,
La2Ca2MnOx中Mn的化合价为:2x-2×3-2×2=2x-10,根据La2Ca2MnOx中Mn得电子总数与C2O42-中C电子总数相等得:
×(2x-10-2)=2×1.000×10-3,解得:x=7.
答:x的值为7.
|
| 10 |
| 1×10-14 | ||
|
| 10-8 | ||
|
(2)当滴定终点时,C2O42-被滴定完毕,再加入高锰酸钾,显示高锰酸钾的颜色,故答案为:溶液变成浅红色,且半分钟内不褪色;
(3)滴定终点俯视,读数偏小,根据此计算的和高锰酸钾反应的C2O42-偏少,则溶解消耗的C2O42-偏大,故测量x值偏大;故答案为:偏大;
(3)样品溶解后,滴定消耗高锰酸钾:10.00mL×0.02000mol/L=0.2000mmol,
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
O.2000mmol 0.5000mmol
样品溶解过程所消耗的C2O42-量:25.00mL×0.06000mol/L-0.5000mmol=1.000mmol,
La2Ca2MnOx中Mn的化合价为:2x-2×3-2×2=2x-10,根据La2Ca2MnOx中Mn得电子总数与C2O42-中C电子总数相等得:
| 0.5250 |
| 413+16x |
答:x的值为7.
点评:本题考查了探究物质组成的计算,涉及沉淀溶解平衡的计算、滴定操作及计算、氧化还原反应的计算,中等难度,注意分清反应过程,利用得失电子守恒来计算x.

练习册系列答案
相关题目
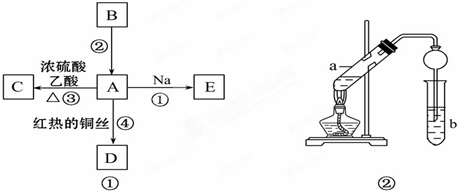
用下列实验装置进行相应实验,能达到实验目的,且实验装置正确的是( )


| A、图1所示装置,检验碳酸钾中钾元素的存在 |
| B、图2所示装置,称量少量氢氧化钠固体 |
| C、图3所示装置,分离CCl4萃取溴水后所得的有机层和水层 |
| D、图4所示装置,分离沸点相差较大的酒精、水的混合物 |
某气体由烯烃和炔烃混合而成,经测定其密度为同条件下H2的13.5倍,则下列说法中正确的是( )
| A、混合气体中一定没有乙炔 |
| B、混合气体中一定有乙烯 |
| C、混合气体可能由乙炔和丙烯组成 |
| D、混合气体可能由丙烯和丙炔组成 |