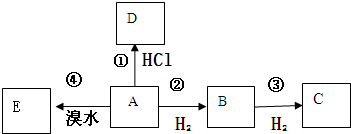
题目内容
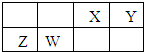
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如下图所示.Z元素原子核外K层与M层电子数相等.下列说法中正确的( )

| A、Y元素最高价氧化物对应的水化物化学式为H3YO4 |
| B、原子半径由小到大的顺序为:X<Z<Y<W |
| C、与同浓度的盐酸反应,Z比W更剧烈 |
| D、W的金属性比Z的强 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W为四种短周期主族元素,Z元素原子核外K层与M层电子数相等,则Z原子M层电子数为2,故Z为Mg元素,由元素周期表中的相对位置可知,W为Al元素、X为C元素、Y为N元素,据此解答.
解答:
解:X、Y、Z、W为四种短周期主族元素,Z元素原子核外K层与M层电子数相等,则Z原子M层电子数为2,故Z为Mg元素,由元素周期表中的相对位置可知,W为Al元素、X为C元素、Y为N元素,
A.Y为N元素,最高价氧化物对应的水化物化学式为HNO3,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径N<C<Al<Mg,故B错误;
C.金属性Mg>Al,故与同浓度的盐酸反应,Mg比Al更剧烈,故C正确;
D.金属性Mg>Al,故D错误,
故选C.
A.Y为N元素,最高价氧化物对应的水化物化学式为HNO3,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径N<C<Al<Mg,故B错误;
C.金属性Mg>Al,故与同浓度的盐酸反应,Mg比Al更剧烈,故C正确;
D.金属性Mg>Al,故D错误,
故选C.
点评:本题考查结构位置性质关系应用,难度不大,注意把握元素周期表的结构、元素周期律的递变规律.

练习册系列答案
相关题目
短周期元素Q、W、X、Y、Z的原子序数依次增大,X元素的颜色反应呈黄色,Q原子的最外层电子数是其内层电子数的2倍,W、Z原子的最外层电子数相同,Z元素的核电荷数是W的2倍,Y是地壳中含量最多的金属元素.下列说法不正确的是( )
| A、工业上常用电解的方法制备X、Y的单质 |
| B、元素Q和Z能形成QZ2型的共价化合物 |
| C、原子半径的大小顺序:r(X)>r(Y)>r(W)>r(Q) |
| D、元素X、Y的最高价氧化物对应的水化物之间能发生反应 |
用下列实验装置进行相应实验,能达到实验目的,且实验装置正确的是( )


| A、图1所示装置,检验碳酸钾中钾元素的存在 |
| B、图2所示装置,称量少量氢氧化钠固体 |
| C、图3所示装置,分离CCl4萃取溴水后所得的有机层和水层 |
| D、图4所示装置,分离沸点相差较大的酒精、水的混合物 |
某研究小组为测定食用白醋中醋酸的含量进行的如下操作,正确的是( )
| A、用碱式滴定管量取一定体积的待测白醋放入锥形瓶中 |
| B、称取4.0gNaOH到1000mL容量瓶加水至刻度,配成1.00 mol?L-1NaOH标准溶液 |
| C、用NaOH溶液滴定白醋,使用酚酞作指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不退色时,为滴定终点 |
| D、滴定时眼睛要注视着滴定管内NaOH溶液的液面变化,防止滴定过量 |
某气体由烯烃和炔烃混合而成,经测定其密度为同条件下H2的13.5倍,则下列说法中正确的是( )
| A、混合气体中一定没有乙炔 |
| B、混合气体中一定有乙烯 |
| C、混合气体可能由乙炔和丙烯组成 |
| D、混合气体可能由丙烯和丙炔组成 |
 某同学按如图所示的装置进行试验.A、B 为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处 SO42-从右向左移动.下列分析错误的是( )
某同学按如图所示的装置进行试验.A、B 为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处 SO42-从右向左移动.下列分析错误的是( )| A、金属活动性A强于B |
| B、B 的电极反应:B-2e一=B2+ |
| C、x电极上有 H2 产生,发生氧化反应 |
| D、反应初期,x 电极周围出现白色沉淀,不久沉淀溶解 |