题目内容
9.运用化学反应原理研究部分单质及其化合物的反应有重要意义.(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料.氨的合成目前普遍使用的人工固氮方法:
N2(g)+3H2(g)?2NH3(g).请回答:
①已知:H-H键能为436kJ/mol,N≡N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=-93kJ/mol.若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”);
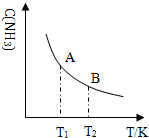
②如图中:当温度由T1变化到T2时,KA> KB(填“>”、“<”或“=”).
(2)氨气溶于水得到氨水.NO2可用氨水吸收生成NH4NO3,25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示),向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将逆向(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为$\frac{a}{200b}$mol/L(用含a、b的代数式表示),(NH3•H2O的电离平衡常数取Kb=2×10-5mol/L)
(3)硫酸生产中,SO2催化氧化生成SO3:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H<0,是工业上生产硫酸的关键步骤.
①在某温度时,该反应的平衡常数K=0.75,若在此温度下,向100L的恒容密闭容器中,充入3molSO2、4mo
lO2和4mol SO3,则反应开始时正反应速率<逆反应速率(填“<”、“>”或“=”).
②在①中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是bc.
a.保持温度和容器体积不变,充入1.0mol SO3(g)
b.保持温度和容器内压强不变,充入2.0mol He
c.降低温度
d.在其他条件不变时,减小容器的容积
③由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,$\frac{c(C{O}_{3}^{2-})}{c(S{O}_{4}^{2-})}$=40.[已知该温度时,Ksp(BaSO4)=1.3×10-10,Ksp(BaCO3)=5.2×10-9].
分析 (1)①反应热=反应物总键能-生成物总键能;
若在恒温、恒压条件下向上述平衡体系中通入氦气,反应体系分压减小,平衡向气体体积增大的方向移动;
②由图可知,温度升高,氨气浓度减小,平衡逆向进行,平衡常数减小;
(2)溶液中NH4+离子水解,使溶液呈酸性;向NH4NO3溶液滴加bL氨水后溶液呈中性,增大NH3•H2O浓度,水的电离程度减小;溶液呈中性,则c(H+)=c(OH-)=10-7mol/L,由电荷守恒可知c(NH4+)=c(NO3-),设混合后溶液体积为1L,则c(NH4+)=c(NO3-)=amol/L,设所滴加氨水的浓度为cmol/L,由微粒守恒可知混合溶液中c(NH3•H2O)=bc mol/L,再根据Kb=$\frac{c(N{{H}_{4}}^{+})×c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=2×10-5计算;
(3)①计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行,进而判断正、逆速率相对大小;
②a.保持温度和容器体积不变,充入1.0mol SO3(g),平衡逆向移动;
b.保持温度和容器内压强不变,充入2.0mol He,容器体积增大,反应混合物各组分浓度均减小;
c.降低温度平衡向正反应方向移动;
d.在其他条件不变时,减小容器的容积,反应混合物各组分浓度均增大;
③BaSO4和BaCO3两种沉淀共存时,则$\frac{c(C{O}_{3}^{2-})}{c(S{O}_{4}^{2-})}$=$\frac{Ksp(BaC{O}_{3})}{Ksp(BaS{O}_{4})}$.
解答 解:(1)①反应N2(g)+3H2(g)?2NH3(g)的反应热△H=945kJ•mol-1+3×436kJ•mol-1-2×3×391kJ•mol-1=-93kJ•mol-1;
恒压条件下向上述平衡体系中通入氦气,反应体系分压减小,正反应为气体体积减小的反应,平衡向左移动,
故答案为:-93kJ/mol;向左;
②由图可知,温度升高,氨气浓度减小,平衡逆向进行,平衡常数减小,则平衡常数KA>KB,
故答案为:>;
③溶液中NH4+离子水解:NH4++H2O?NH3•H2O+H+,使溶液呈酸性;
向NH4NO3溶液滴加bL氨水后溶液呈中性,增大NH3•H2O浓度,水的电离程度减小,水的电离平衡逆向移动;
溶液呈中性,则c(H+)=c(OH-)=10-7mol/L,由电荷守恒可知c(NH4+)=c(NO3-),设混合后溶液体积为1L,则c(NH4+)=c(NO3-)=amol/L,设所滴加氨水的浓度为cmol/L,由微粒守恒可知混合溶液中c(NH3•H2O)=bc mol/L,则Kb=$\frac{c(N{{H}_{4}}^{+})×c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{a×1{0}^{-7}}{bc}$=2×10-5,解得c=$\frac{a}{200b}$,
故答案为:NH4++H2O?NH3•H2O+H+;逆向;$\frac{a}{200b}$;
(2)①在某温度时,SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H<0,该反应的平衡常数K=0.75,若在此温度下,向100L的恒容密闭容器中,充入3mol SO2、4mol O2和4mol SO3,浓度商Qc=$\frac{\frac{4}{100}}{\frac{3}{100}×\sqrt{\frac{4}{100}}}$=6.67>Kc=0.75,反应向逆反应进行,正反应速率小于逆反应速率,
故答案为:<;
②a.保持温度和容器体积不变,充入1.0mol SO3(g),平衡逆向移动,SO2的浓度增大,故a错误;
b.保持温度和容器内压强不变,充入2.0mol He,容器体积增大,反应混合物各组分浓度均减小,故b正确;
c.降低温度平衡向正反应方向移动,SO2的浓度减小,故c正确;
d.在其他条件不变时,减小容器的容积,反应混合物各组分浓度均增大,故d错误,
故选:bc;
③BaSO4和BaCO3两种沉淀共存时,则$\frac{c(C{O}_{3}^{2-})}{c(S{O}_{4}^{2-})}$=$\frac{Ksp(BaC{O}_{3})}{Ksp(BaS{O}_{4})}$=$\frac{5.2×1{0}^{-9}}{1.3×1{0}^{-10}}$=40,
故答案为:40.
点评 本题考查反应热计算、化学平衡影响因素、化学平衡常数、电离平衡常数、溶度积有关计算等,是对学生综合能力的考查,(2)中③氨水浓度计算为易错点,题目难度较大.

| A. | 双键、三键中都含有π键 | |
| B. | 成键原子间原子轨道重叠愈多,共价键愈牢固 | |
| C. | 因每个原子未成对的电子数是一定的,故与其配对的原子个数也一定 | |
| D. | 所有原子轨道在空间中都有自己的方向性 |
| A. | HCl | B. | Ca(HCO3)2溶液 | C. | FeCl3 | D. | CuSO4 |
| A. | H2O中氧元素的化合价为-l | B. | O2中氧元素的化合价为-2 | ||
| C. | NaOH中氧元素的化合价为-2 | D. | Na2O2中氧元素的化合价为-2 |

 实验室用大理石(主要成分为CaCO3,另外含有少量的CaSO3)和稀盐酸反应制备CO2气体,如图装置可用于杂质气体的检验和CO2气体的提纯、干燥.回答下列问题:
实验室用大理石(主要成分为CaCO3,另外含有少量的CaSO3)和稀盐酸反应制备CO2气体,如图装置可用于杂质气体的检验和CO2气体的提纯、干燥.回答下列问题: