题目内容
19.已知A、B、C三种物质之间的转化关系:
(1)若B的溶液中加入KSCN溶液变红色,则A物质为Fe2O3(用化学式表示).
向沸水中逐滴加入饱和B溶液,继续煮沸至溶液呈红褐色,所得分散系中粒子直径大小区间为1nm-100nm.B溶液可用于腐蚀铜线路板,其反应的离子方程式为Cu+2Fe3+=2Fe2++2Cu2+.C→A的化学方程式为2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O.
(2)若A、C均为既能溶于盐酸又能溶于NaOH溶液的白色物质,则C物质是Al(OH)3(用化学式表示).向B溶液中逐滴加入NaOH溶液至过量,则此过程中可观察到现象是先产生白色胶状沉淀,后沉淀溶解,涉及的离子方程式为Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,B→C的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
分析 (1)若B溶液中加入KSCN溶液,有血红色出现,证明含有三价铁离子,A和盐酸反应生成的三价铁离子,和一水合氨反应生成氢氧化铁沉淀,加热生成氧化铁,所以A为Fe2O3,所以B为FeCl3,C为Fe(OH)3,据此答题;
(2)若A、C是不溶于水的白色粉末状物质,既能溶于盐酸又能溶于氢氧化钠溶液,说明A、C是两性物质,溶于酸生成盐和一水合氨反应生成C为氢氧化物沉淀,加热分解生成A为氧化物,即A为Al2O3,所以B为AlCl3,C为Al(OH)3,据此答题.
解答 解:(1)若B溶液中加入KSCN溶液,有血红色出现,证明含有三价铁离子,A和盐酸反应生成的三价铁离子,和一水合氨反应生成氢氧化铁沉淀,加热生成氧化铁,所以A为Fe2O3,所以B为FeCl3,C为Fe(OH)3,向沸水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,得到氢氧化铁胶体,所以所得分散系中粒子直径大小区间为 1nm-100nm,FeCl3溶液可用于腐蚀铜线路板,其反应的离子方程式为 Cu+2Fe3+=2Fe2++2Cu2+,C→A的化学方程式为2Fe(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,
故答案为:Fe2O3;1nm-100nm;Cu+2Fe3+=2Fe2++2Cu2+;2Fe(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O;
(2)若A、C是不溶于水的白色粉末状物质,既能溶于盐酸又能溶于氢氧化钠溶液,说明A、C是两性物质,溶于酸生成盐和一水合氨反应生成C为氢氧化物沉淀,加热分解生成A为氧化物,即A为Al2O3,所以B为AlCl3,C为Al(OH)3,向AlCl3溶液中逐滴加入NaOH溶液至过量,此过程中可观察到现象是 先产生白色胶状沉淀,后沉淀溶解,涉及的离子方程式为 Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,B→C的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al(OH)3;先产生白色胶状沉淀,后沉淀溶解;Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O;Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
点评 本题考查了无机物质的转化关系,物质性质的应用,主要考查铁及其化合物,铝及其化合物性质的应用和判断,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | F- | B. | Cu2+ | C. | S2- | D. | Na+ |
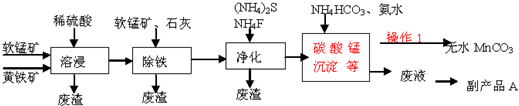
已知:几种金属离子沉淀的pH如表:
| Fe2+ | Fe3+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 10.4 |
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有ABC
A.适当升高温度 B.加压 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:
2FeS2+15MnO2+28H+═2Fe3++15Mn2++4SO42ˉ+14H2O
(3)操作1经过滤、洗涤(填操作名称)烘干等过程可得到无水碳酸锰.
(4)①除铁工序中,先加入适量的软锰矿,其作用是除去可能未被完全氧化的Fe2+,如何检验溶液中的Fe2+已被完全氧化?加入酸性高锰酸钾溶液,观察是否褪色
②再加入石灰调节溶液pH的范围为3.7~5.2.
(5)副产品A的主要成分是(NH4)2SO4.
(6)黄铁矿(主要成分是FeS2)还可以用来制备化工原料FeSO4,FeSO4可转化为FeCO3,
FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:
4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
C(s)+O2(g)═CO2(g)△H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol.
| A. | 水的电离程度始终增大 | |
| B. | 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO?) | |
| C. | c(CH3COOH)与c(CH3COO?)之和始终保持不变 | |
| D. | $\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O}$先增大再减小 |
| 选项 | 实验目的 | 实验方案 |
| A | 验证二氧化硫漂白性 | 二氧化硫通入溴水中,看溶液颜色是否褪色 |
| B | 检验氯化铁溶液中是否含FeCl2 | 向氯化铁溶液中滴加氢氧化钠溶液 |
| C | 检验食盐中是否添加KIO3 | 取食盐试样,溶于KI溶液,加入淀粉溶液,观察溶液是否变蓝 |
| D | 验证Ksp(AgI)>Ksp(AgCl) | 向含等物质的量NaCl、KI的混合液中滴加AgNO3溶液,观察沉淀颜色 |
| A. | A | B. | B | C. | C | D. | D |
 开发利用清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题.甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=-105kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
开发利用清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题.甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=-105kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示: