题目内容
14.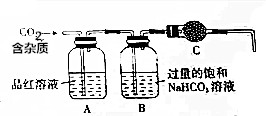 实验室用大理石(主要成分为CaCO3,另外含有少量的CaSO3)和稀盐酸反应制备CO2气体,如图装置可用于杂质气体的检验和CO2气体的提纯、干燥.回答下列问题:
实验室用大理石(主要成分为CaCO3,另外含有少量的CaSO3)和稀盐酸反应制备CO2气体,如图装置可用于杂质气体的检验和CO2气体的提纯、干燥.回答下列问题:(1)用37%的浓盐酸配制500mL 2mol•L-1的稀盐酸,需要的玻璃仪器有500ml容量瓶,量筒,烧杯,玻璃棒,胶头滴管.
(2)品红溶液的作用是检验生成的气体中含有二氧化硫,饱和NaHCO3溶液的作用是吸收杂质气体二氧化硫.不能用NaOH溶液或Na2CO3溶液代替NaHCO3溶液,请用离子方程式解释不能用Na2CO3溶液代替NaHCO3溶液的原因:CO2+CO32-+H2O=2HCO3-.
(3)装置C中盛放的物质是无水CaCl2.
(4)一次性饭盒中石蜡和CaCO3在食物中的溶出量是评价饭盒质量的指标之一.
①从物质分类的角度分析,石蜡属于有机物中的烃类,为了将石蜡从饭盒中溶出,应选用下列试剂中的d(填标号).
a.蒸馏水 b.稀醋酸 c.烧碱溶液 d.乙烷
②饭盒中的碳酸钙常用稀醋酸将其溶出,反应的离子方程式为CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑.
分析 (1)由浓溶液配制稀溶液,利用量筒量取浓硫酸,在烧杯中稀释冷却后转移到容量瓶中,利用胶头滴管定容;
(2)实验室用大理石(主要成分为CaCO3,另外含有少量的CaSO3)和稀盐酸反应制备CO2气体,气体中含有二氧化硫杂质,品红溶液检验二氧化硫的存在,B中过量饱和碳酸氢钠溶液吸收二氧化硫除杂,同时生成二氧化碳气体,不能用NaOH溶液或Na2CO3溶液代替NaHCO3溶液,因为氢氧化钠溶液和碳酸钠溶液都会吸收二氧化硫、二氧化碳;
(3)B物质用于干燥制得的CO2,可选用无水CaCl2;
(4)①根据石蜡的组成判断其有机物类型;根据实验步骤,为将石蜡和碳酸钙溶出,可选用稀醋酸溶出碳酸钙、正己烷溶出石蜡;
②碳酸钙和醋酸反应生成醋酸钙、二氧化碳气体和水,离子方程式中碳酸钙和醋酸都需要保留化学式.
解答 解:(1)由浓溶液配制稀溶液,利用量筒量取浓硫酸,在烧杯中稀释冷却后转移到容量瓶中,利用胶头滴管定容,则需要的玻璃仪器有500ml容量瓶,量筒,烧杯,玻璃棒,胶头滴管,
故答案为:500ml容量瓶,量筒,烧杯,玻璃棒,胶头滴管;
(2)实验原理是利用装置可用于杂质气体的检验和CO2气体的提纯、干燥,气体中含有二氧化硫杂质,品红溶液褪色证明气体中含杂质气体二氧化硫,B中过量饱和碳酸氢钠溶液吸收二氧化硫除杂,同时生成二氧化碳气体,不能用NaOH溶液或Na2CO3溶液代替NaHCO3溶液,因为氢氧化钠溶液和碳酸钠溶液都会吸收二氧化硫、二氧化碳,不能用Na2CO3溶液代替NaHCO3溶液的原因是碳酸钠和二氧化碳水反应生成碳酸氢钠,反应的离子方程式为:CO2+CO32-+H2O=2HCO3-,
故答案为:检验生成的气体中含有二氧化硫;吸收杂质气体二氧化硫;CO2+CO32-+H2O=2HCO3-;
(3)B是用来除去水份的,但这种干燥剂又不能与CO2反应所以是无水氯化钙,
故答案为;无水CaCl2;
(4)①石蜡是有C、H元素组成烃类混合物,有机物类型为烃;根据实验步骤,为将石蜡和碳酸钙溶出,因为醋酸和碳酸钙反应,稀硫酸与碳酸钙反应生成微溶的硫酸钙,可选用稀醋酸溶出碳酸钙,根据相似相容的原理,选择正己烷溶出石蜡,所以d正确;
故答案为:烃;d;
②稀醋酸与碳酸钙反应生成醋酸钙、二氧化碳气体和水,反应的离子方程式为CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑,
故答案为:CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑.
点评 本题考查物质分离提纯实验方案的设计,为高频考点,把握物质的成分、性质、发生的反应及实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度中等.

| t(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO).c({H}_{2}O)}{c(C{O}_{2}).c({H}_{2})}$.
(2)若反应在830℃下达到平衡,则CO2气体的转化率为$\frac{1}{3}$.
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度升高(填“升高”、“降低”或“不能确定”).
(4)在830℃达平衡后在其容器中分别仅充入1mol CO2 和1molCO后,该反应的v正小于 v逆((填“大于”“小于”“等于”),平衡向逆方向移动.
①蒸馏 ②水洗 ③用干燥剂干燥 ④10%NaOH溶液洗.
| A. | ①②③④② | B. | ②④②③① | C. | ④②③①② | D. | ②④①②③ |
| A. | 纯铁是银白色固体 | |
| B. | 钨有很高的熔点 | |
| C. | 铜容易传热、导电 | |
| D. | 铝在空气中易与氧气反应生成致密的氧化膜 |
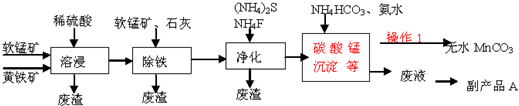
已知:几种金属离子沉淀的pH如表:
| Fe2+ | Fe3+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 10.4 |
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有ABC
A.适当升高温度 B.加压 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:
2FeS2+15MnO2+28H+═2Fe3++15Mn2++4SO42ˉ+14H2O
(3)操作1经过滤、洗涤(填操作名称)烘干等过程可得到无水碳酸锰.
(4)①除铁工序中,先加入适量的软锰矿,其作用是除去可能未被完全氧化的Fe2+,如何检验溶液中的Fe2+已被完全氧化?加入酸性高锰酸钾溶液,观察是否褪色
②再加入石灰调节溶液pH的范围为3.7~5.2.
(5)副产品A的主要成分是(NH4)2SO4.
(6)黄铁矿(主要成分是FeS2)还可以用来制备化工原料FeSO4,FeSO4可转化为FeCO3,
FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:
4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
C(s)+O2(g)═CO2(g)△H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol.