题目内容
5.有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属.三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出).NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒.已知在酸性溶液中,NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O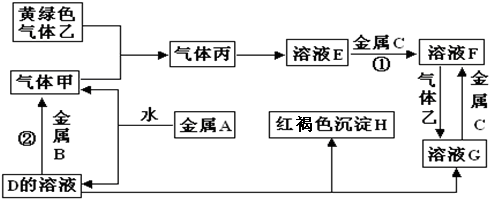
(1)上述反应中氧化剂是NaNO2.
(2)根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白糖 ⑤食醋,你认为下列几组合适的是C(填选项).
A.③⑤B.①②④C.①②③⑤D.①②
(3)某厂废液中,含有2%--5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是B.
A.NaCl B.NH4Cl C.HNO3D.浓H2SO4
(4)请配平以下化学方程式:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O.若反应过程中转移1mol e-,则生成标准状况下N2的体积为2.24L.
分析 金属A焰色反应为黄色,故A为金属Na,与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl$\stackrel{金属C}{→}$物质F$\stackrel{氯气}{→}$物质G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,结合物质的性质解答该题.
解答 解:金属A焰色反应为黄色,故A为金属Na,与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl$\stackrel{金属C}{→}$物质F$\stackrel{氯气}{→}$物质G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,
(1)在反应2NaNO2+4HI=2NO↑+I2+2NaI+2H2O中,碘从-1价变为0价,氮从+3价变为+2价,所以氧化剂是 NaNO2,
故答案为:NaNO2;
(2)鉴别NaNO2和NaCl,可以用在酸性条件下碘化钾被亚硝酸钠氧化成碘单质,再用淀粉检验碘单质,用到的试剂为水、碘化钾淀粉试纸、食醋,故选C;
(3)根据氮元素的化合价的变化可知,NaNO2转化为不引起二次污染的N2时,氮的化合价降低,所以要选的试剂氮元素的化合价要升高,故选B;
(4)在反应Al+NaNO3+NaOH=NaAlO2+N2↑+H2O中,铝元素从0价变为+3价,氮从+5价变为0价,根据电子得失守恒可知,Al的系数为10,NaNO3的系数为6,NaAlO2的系数为10,N2的系数为3,根据钠元素守恒可知,NaOH的系数为4,根据氢元素守恒可知,H2O的系数为2,所以反应方程式为10Al+6 NaNO3+4 NaOH=10NaAlO2+3N2↑+2H2O,该反应中每生成3mol氮气,转移的电子数目为30mol,所以反应过程中转移1mol e-,则生成标准状况下N2的物质的量为0.1mol,其体积为2.24L,
故答案为:10、6、4、10、3、2; 2.24.
点评 本题是考查物质推断与性质、常用化学用语,涉及Na、Fe、Al元素单质化合物的性质及相互转化,注意特殊的颜色与特殊反应是推断的突破口,难度中等,掌握元素化合物的性质是解题的关键,需要学生熟练掌握元素化合物知识.

| A. | 原子半径:ra>rb>rc | B. | 微粒半径:Bn->An+ | ||
| C. | C元素不一定是稀有气体元素 | D. | 原子序数:C>B>A |

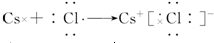 .
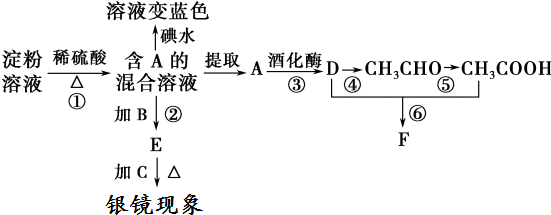
.
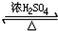 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O