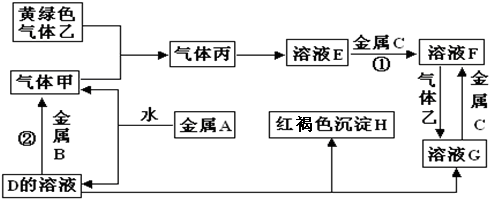
题目内容
18.反应A(g)+3B(g)═2C(g)+2D(g),在四种不同的情况下的反应速率分别为:①v(A)=0.15mol•L-1•s-1
②v(B)=0.6mol•L-1•s-1
③v(C)=0.3mol•L-1•s-1
④v(D)=0.2mol•L-1•s-1
该反应进行最快的是( )
| A. | ① | B. | ② | C. | ③ | D. | ④ |
分析 反应速率之比等于化学计量数之比,则反应速率与化学计量数的比值越大,反应速率越快,以此来解答.
解答 解:反应速率与化学计量数的比值越大,反应速率越快,则
①$\frac{0.15}{1}$=0.15;
②$\frac{0.6}{3}$=0.2;
③$\frac{0.3}{2}$=0.15;
④$\frac{0.2}{2}$=0.1,
显然B表示的反应速率最快,
故选B.
点评 本题考查反应速率的比较,为高频考点,把握化学反应速率与化学计量数成正比为解答的关键,侧重分析与应用能力的考查,注意比值法应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8. 如图所示的装置中,M为活动性顺序表中位于氢之前的金属,N为石墨棒,关于此装置的下列叙述中,不正确的是( )
如图所示的装置中,M为活动性顺序表中位于氢之前的金属,N为石墨棒,关于此装置的下列叙述中,不正确的是( )
 如图所示的装置中,M为活动性顺序表中位于氢之前的金属,N为石墨棒,关于此装置的下列叙述中,不正确的是( )
如图所示的装置中,M为活动性顺序表中位于氢之前的金属,N为石墨棒,关于此装置的下列叙述中,不正确的是( )| A. | 导线中有电流通过,电流方向是由N到M | |
| B. | N上有气体放出 | |
| C. | M为正极,N为负极 | |
| D. | 是化学能转变为电能的装置 |
9.下列说法中正确的是( )
| A. | 按系统命名法,化合物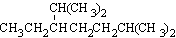 的名称为2,6-二甲基-5-乙基庚烷 的名称为2,6-二甲基-5-乙基庚烷 | |
| B. | 苯和油脂均不能使酸性KMnO4溶液褪色 | |
| C. | 有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.7%,则能在碱性溶液中发生反应的X的同分异构体有(不考立体异构)13种 | |
| D. | 检验卤代烃中的卤素原子种类的方法是:加入NaOH溶液共热,再加AgNO3溶液,观察沉淀颜色 |
13.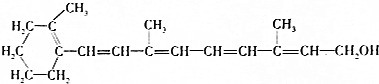 维生素A1是一切健康上皮组织必需的物质,缺乏维生素A1时会引起儿童发育不良,导致夜盲症、皮肤干燥等.已知维生素A1的结构简式如图:下列有关维生素A1的叙述错误的是( )
维生素A1是一切健康上皮组织必需的物质,缺乏维生素A1时会引起儿童发育不良,导致夜盲症、皮肤干燥等.已知维生素A1的结构简式如图:下列有关维生素A1的叙述错误的是( )
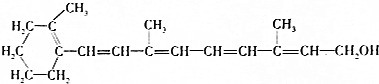 维生素A1是一切健康上皮组织必需的物质,缺乏维生素A1时会引起儿童发育不良,导致夜盲症、皮肤干燥等.已知维生素A1的结构简式如图:下列有关维生素A1的叙述错误的是( )
维生素A1是一切健康上皮组织必需的物质,缺乏维生素A1时会引起儿童发育不良,导致夜盲症、皮肤干燥等.已知维生素A1的结构简式如图:下列有关维生素A1的叙述错误的是( )| A. | 维生素A1中含有两种官能团 | |
| B. | 维生素A1的分子式为C18H26O | |
| C. | 维生素A1可使酸性KMnO4溶液褪色 | |
| D. | 维生素A1分子中含有苯环,1mol维生素A1最多可与7molH2发生加成反应 |
1.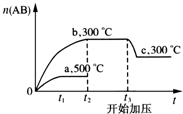 可逆反应:A2(?)+B2(?)?2AB(?),当温度和压强改变时n(AB)的变化如图,下列叙述正确的是( )
可逆反应:A2(?)+B2(?)?2AB(?),当温度和压强改变时n(AB)的变化如图,下列叙述正确的是( )
 可逆反应:A2(?)+B2(?)?2AB(?),当温度和压强改变时n(AB)的变化如图,下列叙述正确的是( )
可逆反应:A2(?)+B2(?)?2AB(?),当温度和压强改变时n(AB)的变化如图,下列叙述正确的是( )| A. | A2、B2及AB均为气体,△H<0 | |
| B. | AB为气体,A2、B2至少有一种为非气体,△H<0 | |
| C. | AB为气体,A2、B2有一种为非气体,△H>0 | |
| D. | AB为固体,A2、B2有一种为非气体,△H>0 |
8.影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.研究的实验报告如下表:
(1)该同学的实验目的是探究反应物本身的性质对反应速率的影响;
要得出正确的实验结论,还需控制的实验条件是温度相同.
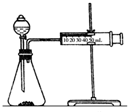
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用的影响.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
要得出正确的实验结论,还需控制的实验条件是温度相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.

实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用的影响.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
6.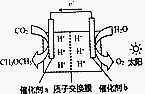 模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )
模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )
 模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )
模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )| A. | H+由交换膜右侧向左侧迁移 | |
| B. | 催化剂a表面发生的反应是2CO2+12e-+12H+═CH3OCH3+3H2O | |
| C. | 该过程是太阳能转化为化学能的过程 | |
| D. | 消耗CO2与生成O2体积比为1:1 |
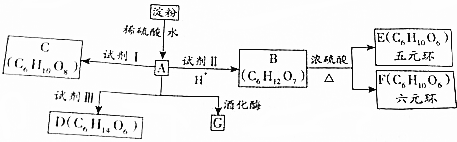
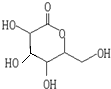 、OHC(CHOH)4COOH;E、F两种物质的关系是同分异构体.
、OHC(CHOH)4COOH;E、F两种物质的关系是同分异构体.