题目内容
13.填写下列空白:(1)写出表示含有8个质子、10个中子的原子的化学符号:${\;}_{8}^{18}$O.
(2)周期表中位于第8纵行的铁元素属于第Ⅷ族.
(3)所含元素超过18种的周期是第六、七周期.
(4)用电子式写出氯化铯的形成过程
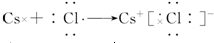 .
.(5)两种同主族元素的原子序数之和是另外两种同主族元素的原子序数之和的2倍,写出由这4种元素共同组成的2种化合物在水溶液中发生反应的离子方程式:H++HSO3-=SO2↑+H2O.
分析 (1)质子数=原子序数,质子数+中子数=质量数,根据原子表示法来回答;
(2)根据元素周期表中元素和周期以及族的分布知识来回答;
(3)含有镧系和锕系元素的周期含有的元素种类较多;
(4)氯化铯为离子化合物;
(5)若四种元素都是第二、第三周期元素,原子序数之和最小为Li、Na,其原子序数之和为3+11=14,最大为F、Cl,其原子序数之和为:9+17=26,不可能满足2倍的关系;所以一定含有H元素,ⅠA族的另一种元素只能为Na,二者的原子序数之和为:11+1=12,另外两种同主族短周期元素的原子序数之和为12×2=24,设一种元素的原子序数为x,另一种元素的原子序数为x+8,则x+x+8=24,解得:x=8,为O元素,另一种为S元素,据此进行解答.
解答 解:(1)质子数=原子序数,质子数决定元素种类,所以含有8个质子的元素是O,并且质子数+中子数=质量数,所以该元素的质量数是18,表示为8180,
故答案为:${\;}_{8}^{18}$O;
(2)周期表中位于第8纵列的铁元素属于Ⅷ族,故答案为:Ⅷ;
(3)元素周期表中,在第6、7(或六、七)周期的第ⅢB族出现镧系和锕系元素,所含元素种数最多,故答案为:六;七;
(4)氯化铯为离子化合物,形成过程为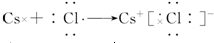 ,故答案为:
,故答案为: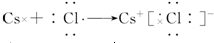 ;
;
(5)根据元素周期表结构可知,若四种元素都是第二、第三周期元素,原子序数之和最小为Li、Na,其原子序数之和为3+11=14,最大为F、Cl,其原子序数之和为:9+17=26,不可能满足2倍的关系;所以一定含有H元素,ⅠA族的另一种元素只能为Na,二者的原子序数之和为:11+1=12,另外两种同主族短周期元素的原子序数之和为12×2=24,设一种元素的原子序数为x,另一种元素的原子序数为x+8,则x+x+8=24,解得:x=8,为O元素,另一种为S元素,
根据分析可知,四种元素分别为H、Na、O、S元素,由这4种元素组成的2种化合物分别为NaHSO4、NaHSO3,二者反应生成硫酸钠、二氧化硫气体和水,反应的离子方程式为:H++HSO3-=SO2↑+H2O,
故答案为:H++HSO3-=SO2↑+H2O.
点评 本题考查了原子结构与元素的性质,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.

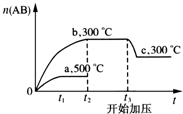 可逆反应:A2(?)+B2(?)?2AB(?),当温度和压强改变时n(AB)的变化如图,下列叙述正确的是( )
可逆反应:A2(?)+B2(?)?2AB(?),当温度和压强改变时n(AB)的变化如图,下列叙述正确的是( )| A. | A2、B2及AB均为气体,△H<0 | |
| B. | AB为气体,A2、B2至少有一种为非气体,△H<0 | |
| C. | AB为气体,A2、B2有一种为非气体,△H>0 | |
| D. | AB为固体,A2、B2有一种为非气体,△H>0 |
实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
要得出正确的实验结论,还需控制的实验条件是温度相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用的影响.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
| A. | 丙烷分子中3个碳原子一定在同一条直线上 | |
| B. | 甲苯分子中7个碳原子都在同一平面上 | |
| C. | 3-甲基-1-丁炔分子中所有碳原子都在同一平面上 | |
| D. | 2-丁烯分子中4个碳原子有可能在同一条直线上 |
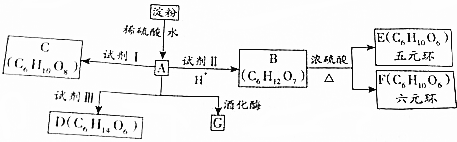
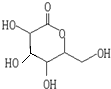 、OHC(CHOH)4COOH;E、F两种物质的关系是同分异构体.
、OHC(CHOH)4COOH;E、F两种物质的关系是同分异构体.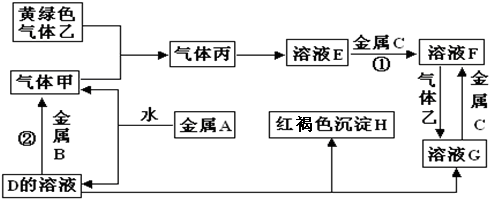
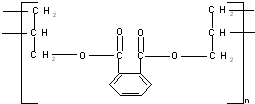
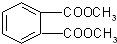
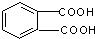 ⑤邻苯二甲酸甲酯
⑤邻苯二甲酸甲酯