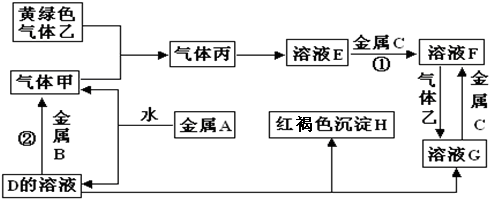
题目内容
14.比较下列物质性质的关系(填:<或>)稳定性:HF>HCl
熔沸点:NH3<H2O
酸 性:H2SO3>H2CO3.
分析 元素非金属性越强,气态氢化物越稳定;
O的电负性比N大,O的原子半径比N小,O-H…O的键能大于N-H…N;
H2SO3+Na2CO3=Na2SO3+CO2↑+H2O,较强酸制取较弱酸.
解答 解:同主族自下而上,非金属性逐渐增强,因此非金属性F>Cl,元素非金属性越强,气态氢化物越稳定,所以稳定性HF>HCl;
O的电负性比N大,O的原子半径比N小,因此O-H…O的键能大于N-H…N,键能越大熔沸点越高,所以H2O的熔沸点大于的NH3熔沸点;
其一,H2SO3+Na2CO3=Na2SO3+CO2↑+H2O,符合“较强酸制取较弱酸”原理,其二,H2SO3的Ka1=1.23×10-2,H2CO3的Ka1=4.45×10-7,因此H2SO3的酸性大于H2CO3,
故答案为:>;<;>.
点评 本题考查非金属性、熔沸点、酸性的比较,为高频考点,侧重于学生的分析能力的考查,注意把握元素在周期表中的变化规律,题目难度不大.

练习册系列答案
相关题目
2.下列叙述正确的是( )
| A. | 丙烷分子中3个碳原子一定在同一条直线上 | |
| B. | 甲苯分子中7个碳原子都在同一平面上 | |
| C. | 3-甲基-1-丁炔分子中所有碳原子都在同一平面上 | |
| D. | 2-丁烯分子中4个碳原子有可能在同一条直线上 |
19.能够用键能大小解释的是( )
| A. | 氮气的化学性质比氧气稳定 | |
| B. | 常温、常压下,溴呈液态,碘呈固态 | |
| C. | 稀有气体一般很难发生化学反应 | |
| D. | 相同状态下,氯气的密度比空气的大 |
6.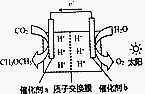 模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )
模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )
 模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )
模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )| A. | H+由交换膜右侧向左侧迁移 | |
| B. | 催化剂a表面发生的反应是2CO2+12e-+12H+═CH3OCH3+3H2O | |
| C. | 该过程是太阳能转化为化学能的过程 | |
| D. | 消耗CO2与生成O2体积比为1:1 |
3.DAP是电器和仪表部件中常用的一种合成高分子化合物,它的结构简式为:
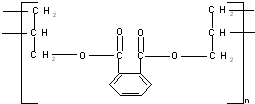
则合成此高分子的单体可能是( )
①乙烯CH2=CH2 ②丙烯CH3CH=CH2③丙烯醇HOCH2CH=CH2④邻苯二甲酸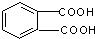 ⑤邻苯二甲酸甲酯
⑤邻苯二甲酸甲酯 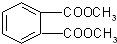

则合成此高分子的单体可能是( )
①乙烯CH2=CH2 ②丙烯CH3CH=CH2③丙烯醇HOCH2CH=CH2④邻苯二甲酸
 ⑤邻苯二甲酸甲酯
⑤邻苯二甲酸甲酯 
| A. | ①② | B. | ③④ | C. | ②④ | D. | ③⑤ |
4.下列实验操作正确的是( )


| A. | 用pH试纸测定浓硫酸的pH | |
| B. | 向碘酒中加入CCl4,静置后分液,可以分离碘酒中的碘 | |
| C. | 用甲图装置验证FeCl3对H2O2分解反应有催化作用 | |
| D. | 用乙图装置验证NaHCO3和Na2CO3的热稳定性 |
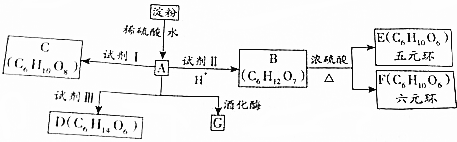
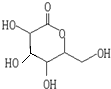 、OHC(CHOH)4COOH;E、F两种物质的关系是同分异构体.
、OHC(CHOH)4COOH;E、F两种物质的关系是同分异构体.