题目内容
20.根据下列转化关系,回答有关问题: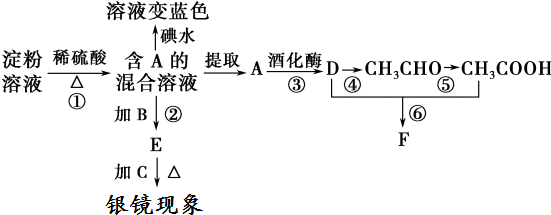
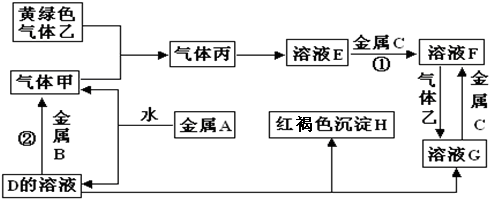
(1)B、C试剂分别是NaOH、银氨溶液.
(2)①、⑤和⑥反应的化学方程式分别是:
①(C6H10O5)n+nH2O$→_{△}^{催化剂}$nC6H12O6
⑤2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH
⑥CH3COOH+CH3CH2OH
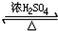 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O(3)由图示转化关系可知淀粉部分水解(填“部分水解”或“完全水解”).
分析 淀粉在酸性条件下水解生成葡萄糖:(C6H10O5)n+nH2O$→_{△}^{催化剂}$nC6H12O6 ,加碱中和之后溶液呈碱性,然后加入银氨溶液,有单质银生成可检验产物葡萄糖;淀粉遇碘单质变蓝.
解答 解:(1)淀粉在稀硫酸作用下水解生成葡萄糖,加Na0H溶液中和稀硫酸,使混合液呈碱性,然后加入银氨溶液,有单质银生成可检验产物葡萄糖,证明淀粉已水解,由水解后的溶液加碘水变蓝,则说明水解不完全.
故答案为:NaOH;银氨溶液;
(2)反应①淀粉在酸性条件下水解生成葡萄糖:(C6H10O5)n+nH2O$→_{△}^{催化剂}$nC6H12O6 ,
反应②葡萄糖在水浴加热条件下发生银镜反应,反应的方程式为CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH$\stackrel{水浴}{→}$CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O,
反应③葡萄糖转化为乙醇的化学反应方程式为:C6H12O6$\stackrel{酒化酶}{→}$2C2H5OH+2CO2↑.
反应④乙醇被氧化成乙醛,乙醇中含-OH,能发生催化氧化,反应的化学反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
反应⑤乙醛被氧化成乙酸,反应的方程式为:2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH,
反应⑥乙醇和乙酸的酯化反应,反应的方程式为:CH3COOH+CH3CH2OH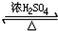 CH3COOCH2CH3+H2O;,
CH3COOCH2CH3+H2O;,
故答案为:(C6H10O5)n+nH2O$→_{△}^{催化剂}$nC6H12O6 ;2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH;CH3COOH+CH3CH2OH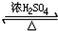 CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(3)加入银氨溶液,有单质银生成可检验产物葡萄糖,证明淀粉已水解,由水解后的溶液加碘水变蓝,则说明水解不完全,
故答案为:部分水解.
点评 本题考查淀粉水解程度的判断,若证明完全水解,加入碘水即可;若证明部分水解,需加入银氨溶液或氢氧化铜证明水解,再加入碘水证明部分水解,题目难度不大.

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案| A. | 铝表面有一层致密的氧化物薄膜,故铝制容器可用来腌制咸菜等 | |
| B. | 如果发生氯气泄漏,附近人员应迅速远离液氯泄漏地点,并顺风往低洼区域疏散 | |
| C. | “低碳生活”倡导生活中尽量减少耗能,从而减少CO2排放 | |
| D. | 向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量 |
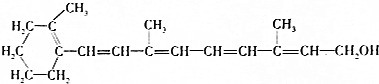 维生素A1是一切健康上皮组织必需的物质,缺乏维生素A1时会引起儿童发育不良,导致夜盲症、皮肤干燥等.已知维生素A1的结构简式如图:下列有关维生素A1的叙述错误的是( )
维生素A1是一切健康上皮组织必需的物质,缺乏维生素A1时会引起儿童发育不良,导致夜盲症、皮肤干燥等.已知维生素A1的结构简式如图:下列有关维生素A1的叙述错误的是( )| A. | 维生素A1中含有两种官能团 | |
| B. | 维生素A1的分子式为C18H26O | |
| C. | 维生素A1可使酸性KMnO4溶液褪色 | |
| D. | 维生素A1分子中含有苯环,1mol维生素A1最多可与7molH2发生加成反应 |
实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
要得出正确的实验结论,还需控制的实验条件是温度相同.
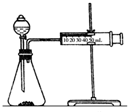
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用的影响.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
| 选项 | 事 实 | 解 释 |
| A | 金属镁燃烧不能用CO2来扑灭 | 镁与CO2要反应 |
| B | 一滴水中大约有1.67×1021个水分子 | 水分子很小 |
| C | 敞口容器中的酒精逐渐减少 | 分子是不断运动的 |
| D | 遭到核辐射后要多吃含“碘”食物 | 碘元素能屏蔽核辐射 |
| A. | A | B. | B | C. | C | D. | D |
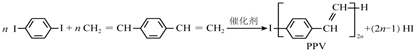
下列说法正确的是( )
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. |  和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 1mol 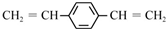 最多可以和5mol氢气发生加成反应 最多可以和5mol氢气发生加成反应 |
| A. | 氢氧燃枓电池、铅蓄电池、硅太阳能电池都利用了原电池原理 | |
| B. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| C. | 为防止重金属等污染土壤和水体,废电池应回收综合利用 | |
| D. | 用可降解的“玉米塑料”制作一次性饭盒,能减少“白色污染” |