题目内容
15.如图1所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题: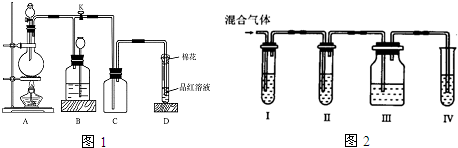
Ⅰ.(1)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.
(2)装置D中试管口放置的棉花中应浸有一种液体,这种液体是,其作用是防止二氧化硫逸出.
(3)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体是d(填写字母代号)
a.水 b.浓溴水 c.KMnO4酸性溶液 d.NaHSO3饱和溶液
Ⅱ.为了验证木炭和浓H2SO4反应生成了SO2和CO2,有人设计了如图2实验.
(提示:酸性高猛酸钾溶液可把SO2氧化成H2SO4,试剂可以重复使用)
(4)各装置中盛放的试剂是(填序号):
ⅠAⅡDⅢAⅣC
A.品红溶液 B.NaOH溶液C.澄清石灰水 D.高锰酸钾溶液
(5)能说明SO2存在的现象是Ⅰ装置中溶液褪色.
(6)使用装置Ⅱ的目的是除二氧化硫.
(7)使用装置Ⅲ的目的是检验二氧化硫是否除尽.
(8)确认含有CO4的现象是Ⅲ中溶液不褪色,Ⅳ中出现白色沉淀.
分析 Ⅰ.(1)烧瓶中铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水;
(2)二氧化硫有毒,需要使用氢氧化钠溶液进行尾气处理;
(3)根据装置Ⅱ的作用是“贮存多余的二氧化硫”,所以Ⅱ中盛放的液体不能使二氧化硫的量减少,据此进行判断;
Ⅱ.验证木炭可被浓H2SO4氧化成CO2,由装置可知,混合气体是C与浓硫酸反应生成二氧化碳、二氧化硫、水蒸气,先用Ⅰ检验有二氧化硫生成,然后通过Ⅱ除去二氧化硫,再通过Ⅲ,利用品红不褪色说明二氧化硫除尽,最后通过Ⅳ,石灰水变浑浊,说明有二氧化碳生成,据此连接装置;
(4)先利用品红溶液检验二氧化硫存在,再通过高锰酸钾溶液除去二氧化硫,再通过品红溶液检验二氧化硫是否除净,最后通过澄清石灰水检验二氧化碳的存在;
(5)能说明SO2存在的现象是装置Ⅰ中品红溶液褪色;
(6)装置Ⅱ的目的是除去二氧化硫;
(7)装置Ⅲ的目的是利用品红溶液检验二氧化硫是否除净;
(8)确认含有CO2的现象是装置Ⅲ不褪色,装置Ⅳ变浑浊.
解答 解:Ⅰ.(1)烧瓶中铜在加热条件下与浓硫酸反应生成二氧化硫气体、硫酸铜和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;
(2)铜与浓硫酸反应生成的二氧化硫有毒,容易组成大气污染,需要使用碱液溶液吸收多余的二氧化硫,所以该液体可以为氢氧化钠溶液,目的是防止二氧化硫逸出,
故答案为:氢氧化钠溶液;防止二氧化硫逸出;
(3)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体不能导致二氧化硫减少,
a.二氧化硫易溶于水,B中液体不能使用水,故a错误;
b.浓溴水能够氧化二氧化硫,导致二氧化硫减少,故b错误;
c.KMnO4酸性溶液能够氧化二氧化硫,导致二氧化硫减少,故c错误;
d.二氧化硫在饱和亚硫酸钠溶液中溶解度较小,该液体可以为亚硫酸钠饱和溶液,故d正确;
故答案为:d.
Ⅱ.验证木炭可被浓H2SO4氧化成CO2,由装置可知,混合气体是C与浓硫酸反应生成二氧化碳、二氧化硫、水蒸气,先用Ⅰ检验有二氧化硫生成,然后通过Ⅱ除去二氧化硫,再通过Ⅲ,利用品红不褪色说明二氧化硫除尽,最后通过Ⅳ,石灰水变浑浊,说明有二氧化碳生成,据此连接装置;
(4)先利用品红溶液检验二氧化硫存在,再通过高锰酸钾溶液除去二氧化硫,再通过品红溶液检验二氧化硫是否除净,最后通过澄清石灰水检验二氧化碳的存在,各装置中盛放的试剂是A; D; A; C,
故答案为:A; D; A; C;
(5)装置Ⅰ中品红溶液褪色,能说明SO2存在,
故答案为:Ⅰ装置中溶液褪色;
(6)二氧化硫具有还原性,遇到高锰酸钾溶液发生氧化还原反应,装置Ⅱ的目的是除去二氧化硫,
故答案为:除二氧化硫;
(7)装置Ⅲ的目的是利用品红溶液检验二氧化硫是否除净,当品红溶液不褪色证明二氧化硫除净,
故答案为:检验二氧化硫是否除尽;
(8)确认含有CO2的现象是Ⅲ中溶液不褪色,Ⅳ中出现白色沉淀,
故答案为:Ⅲ中溶液不褪色,Ⅳ中出现白色沉淀.
点评 本题考查浓硫酸的性质及常见气体的检验,为高频考点,题目难度中等,把握反应原理、物质的性质、实验装置的作用为解答的关键,侧重分析与实验能力的考查.

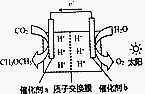 模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )
模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )| A. | H+由交换膜右侧向左侧迁移 | |
| B. | 催化剂a表面发生的反应是2CO2+12e-+12H+═CH3OCH3+3H2O | |
| C. | 该过程是太阳能转化为化学能的过程 | |
| D. | 消耗CO2与生成O2体积比为1:1 |
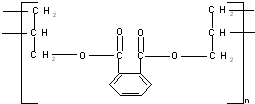
则合成此高分子的单体可能是( )
①乙烯CH2=CH2 ②丙烯CH3CH=CH2③丙烯醇HOCH2CH=CH2④邻苯二甲酸
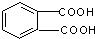 ⑤邻苯二甲酸甲酯
⑤邻苯二甲酸甲酯 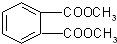
| A. | ①② | B. | ③④ | C. | ②④ | D. | ③⑤ |
| A. | 氢氧燃枓电池、铅蓄电池、硅太阳能电池都利用了原电池原理 | |
| B. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| C. | 为防止重金属等污染土壤和水体,废电池应回收综合利用 | |
| D. | 用可降解的“玉米塑料”制作一次性饭盒,能减少“白色污染” |
6C(s)+5H2(g)+3N2(g)+9O2(g)═2C3H5(ONO2)3(l)△H1
2H2(g)+O2(g)═2H2O(g)△H2
C(s)+O2(g)═CO2(g)△H3
则反应4C3H5(ONO2)3(l)═12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为( )
| A. | △H1-5△H2-12△H3 | B. | 2△H1-5△H2-12△H3 | C. | 12△H3-5△H2-2△H1 | D. | 12△H3+5△H2-2△H1 |
| A. | 苯酚、甲醛通过加聚反应可制得酚醛树脂 | |
| B. | 75%的酒精可使蛋白质变性从而起到消毒作用 | |
| C. | 纤维素在人体内可水解成葡萄糖,供人体组织的营养需要 | |
| D. | 天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点 |

| A. | 用pH试纸测定浓硫酸的pH | |
| B. | 向碘酒中加入CCl4,静置后分液,可以分离碘酒中的碘 | |
| C. | 用甲图装置验证FeCl3对H2O2分解反应有催化作用 | |
| D. | 用乙图装置验证NaHCO3和Na2CO3的热稳定性 |
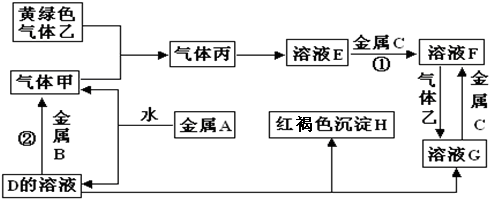
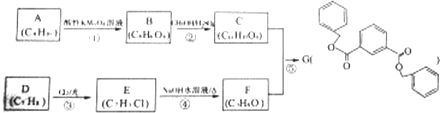
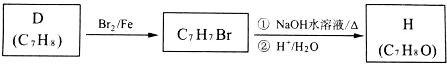
 .
.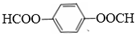 .
.