题目内容
1.碳酸钠晶体在加热时会失去全部结晶水,而碳酸钠本身不分解.Na2CO3•xH2O $\stackrel{加热}{→}$ Na2CO3+x H2O
现有一种碳酸钠晶体(Na2CO3•xH2O),为了测定其组成,某学生在不同温度下给试样加热(温度逐次升高),实验结果记录如下:
坩埚质量32.500g;(坩埚+晶体试样)的质量55.700g.
| 实验次数 | 温度(℃) | 冷却后(坩埚+试样)的质量(g) |
| 1 | T1 | 48.500 |
| 2 | T2 | 44.900 |
| 3 | T3 | 43.100 |
| 4 | T4 | 43.100 |
(2)计算确定碳酸钠晶体(Na2CO3•xH2O )中的x值.(写出计算过程)
分析 (1)实验取用晶体样品的质量为坩埚+晶体试样)的质量减去坩埚的质量;由表可知,第三次和第四次对晶体样品加热后坩埚和样品的质量无变化,于是知原样品中Na2CO3的质量为:43.1g-32.5g=10.6g;
(2)由表可知,晶体(Na2CO3•xH2O )样品中含结晶水的质量为:55.7g-43.1g=12.6g,从而计算该晶体中x的值.
解答 解:(1)实验取用晶体样品的质量为55.700g-32.500g=23.2g,由表可知,第三次和第四次对晶体样品加热后坩埚和样品的质量无变化,于是知原样品中Na2CO3的质量为:43.1g-32.5g=10.6g,故答案为:23.2g;10.6g;
(2)晶体(Na2CO3•xH2O )样品中含结晶水的质量为:55.7g-43.1g=12.6g,
Na2CO3•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+xH2O
106 18x
10.6g 12.6g
则:$\frac{106}{10.6}=\frac{18x}{12.6}$,解得:x=7
答:Na2CO3•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+xH2O
106 18x
10.6g 12.6g
则:$\frac{106}{10.6}=\frac{18x}{12.6}$,解得:x=7.
点评 本题考查了物质组成的测定,侧重于实验操作和数据处理等知识的考查,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 10℃3mol/L的盐酸溶液 | B. | 20℃2mol/L的盐酸溶液 | ||
| C. | 20℃2mol/L的盐酸溶液 | D. | 20℃4mol/L的盐酸溶液 |
| A. | 2 种 | B. | 4 种 | C. | 8 种 | D. | 16 种 |
| A. | 乙烯与溴水的反应 | B. | 甲烷与氯气的反应 | ||
| C. | 乙醇与乙酸的反应 | D. | 苯的燃烧 |
| X | Y | ||
| Z | W |
| A. | 常温下,四种元素单质中,全部是固体 | |
| B. | Z的阳离子与Y的阴离子电子层结构相同 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | W元素原子半径比Z元素原子半径大 |
| A. | NH4+K+NO3-Cl- | B. | NO3-CO32-K+Na+ | ||
| C. | K+Na+ Cl-SO42- | D. | Mg2+Cu2+SO42-Cl- |
| A. | 氯化钠 | B. | 氨气 | C. | NH4Cl的电子式  | D. | 硫化钠 |
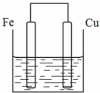 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:(以下均假设反应过程中溶液体积不变).
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:(以下均假设反应过程中溶液体积不变).