题目内容
10.将3.2g铜与过量浓硫酸共热反应,下列叙述中错误的是( )| A. | 铜片溶解,生成物冷却后加水稀释溶液成蓝色 | |
| B. | 生成的气体体积为1.12L | |
| C. | 参加反应的硫酸与被还原的硫酸物质的量之比为2:1 | |
| D. | 该实验中可用NaOH溶液处理尾气 |
分析 铜与浓硫酸在加热条件下发生:Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O,结合反应的方程式解答该题.
解答 解:铜与浓硫酸在加热条件下发生:Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O,n(Cu)=$\frac{3.2g}{64g/mol}$=0.05mol,
A.反应生成CuSO4,生成物冷却后加水稀释溶液成蓝色,故A正确;
B.由方程式可知产生SO20.05mol,标准状况下的体积为1.12L,但题目没有给出气体存在的条件,故B错误;
C.由方程式可知,参加反应的硫酸与被还原的硫酸物质的量之比为2:1,故C正确;
D.二氧化硫可与碳酸钠溶液反应,则实验中可用Na2CO3溶液处理尾气,故D正确.
故选B.
点评 本题综合考查浓硫酸的性质,为高考常见题型和高频考点,注意浓硫酸的特性,学习中注意相关基础知识的积累,正确书写反应的化学方程式为解答该题的关键,难度不大.

练习册系列答案
相关题目
7.下列物质的名称错误的是( )
| A. | 2,2-二甲基-3-丁烯 | B. | 2,2-二甲基-3-乙基庚烷 | ||
| C. | 2-甲基-3-乙基戊烷 | D. | 2,3-二甲基戊烷 |
19.如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
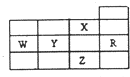

| A. | P亚层未成对电子最多的是Z元素 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | W元素的第一电离能小于Y元素的第一电离能 | |
| D. | X元素是电负性最大的元素 |
20.由乙醛和丁酸、乙酸乙酯三种有机物按一定比例组成的混合物中,若含氧的质量分数为A%,则此混合物中含碳的质量分数为( )
| A. | $\frac{6A%}{7}$ | B. | $\frac{(1-A%)}{7}$ | C. | $\frac{6(1-A%)}{7}$ | D. | (100-$\frac{7A}{6}$)% |
 ; (2)铝离子的结构示意图:
; (2)铝离子的结构示意图: ;
;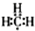
 ; (6)NH4Cl的电子式:
; (6)NH4Cl的电子式: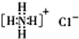 ;
; ,氯化钙
,氯化钙 ,硫化氢 结构式:H-S-H.以上三种物质中其中属于共价化合物的是H2S,晶体类型为分子晶体.
,硫化氢 结构式:H-S-H.以上三种物质中其中属于共价化合物的是H2S,晶体类型为分子晶体.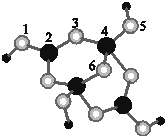 (1)区分晶体和非晶体常用方法为X-射线衍射实验.
(1)区分晶体和非晶体常用方法为X-射线衍射实验.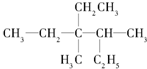 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷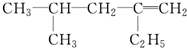
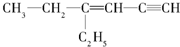 ,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8
,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8