题目内容
11.用如图所示实验装置(夹持仪器己略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )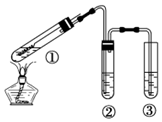
| A. | ②中选用品红溶液验证SO2的生成 | |
| B. | ③中选用NaOH溶液吸收多余的SO2 | |
| C. | 为确认有CuSO4生成,向①中加水,观察颜色 | |
| D. | 上下移动①中铜丝可控制SO2的产生与停止 |
分析 A.品红能被二氧化硫漂白,根据SO2的漂白性分析;
B.SO2为酸性氧化物,可与碱发生反应;
C.不应将水加入过量的浓硫酸中,否则易产生暴沸现象;
D.在加热的条件下,当铜丝与浓硫酸接触时才能反应.
解答 解:A.SO2具有漂白性,品红能被二氧化硫漂白,可用品红溶液验证SO2的生成,故A正确;
B.SO2为酸性气体,具有污染性,可与碱发生反应,生成亚硫酸钠和水,可用NaOH溶液吸收多余的SO2,故B正确;
C.实验中,铜丝与过量浓硫酸的反应生成是硫酸铜,试管中还含有过量的浓硫酸,为确认CuS04生成,应用胶头滴管将试管1中的液体取出少量,滴入水中,观察溶液颜色,若溶液显蓝色,证明有硫酸铜生成,反之则无,而不应将水加入过量的浓硫酸中,否则易产生暴沸现象,故C错误;
D.在加热的条件下,当铜丝与浓硫酸接触时才能反应,当往上抽动铜丝时,铜丝与硫酸不接触,反应停止,故可通过上下移动①中铜丝可控制SO2的量,故D正确;
故选C.
点评 本题考查了二氧化硫的性质,题目难度不大,注意二氧化硫的酸性和漂白性.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
1.已知An+、B(n+1)+、Cn-、D(n+1)-具有相同的电子层结构.下列关于A、B、C、D四种元素的叙述中正确的是( )
| A. | 气态氢化物的稳定性:D>C | |
| B. | 原子序数:B>A>C>D | |
| C. | 最高价氧化物对应水化物的碱性:B>A | |
| D. | 四种元素一定都属于短周期元素 |
2.NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的 催化剂研究催化剂常具有较强的选择性,即专一性.已知:
反应 I:4NH3(g)+5O2(g)$\stackrel{PtRu}{?}$4NO(g)+6H2O(g)△H=-905.0kJ•mol-1
反应 II:4NH3(g)+3O2(g)$?_{高温}^{CU/TiO_{2}}$2N2(g)+6H2O(g)△H
(1)
△H=-1260KJ/mol.
(2)在恒温恒容装置中充入一定量的 NH3 和 O2,在某催化剂的作用下进行反应 I,则下 列有关叙述中正确的是A.
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内 4v 正(NH3)=6v 逆(H2O)时,说明反应已达平衡
C.当容器内 $\frac{n(NO)}{n(N{H}_{3})}$=1 时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应 I、II.为分析某催化剂对该反应的选择性,在 1L 密闭容器中充入 1mol NH3和 2mol O2,测得有关物质的量关系如图:
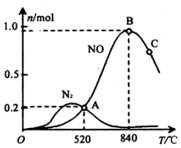
①该催化剂在高温时选择反应I(填“I”或“II”).
②520℃时,4NH3(g)+5O2?4NO(g)+6H2O(g)的平衡常数K=$\frac{0.{2}^{4}×0.{9}^{6}}{0.{4}^{4}×1.4{5}^{5}}$(不要求得出计算结果,只需列出数字计算式).
③有利于提高 NH3 转化为 N2 平衡转化率的措施有E
A.使用催化剂 Pt/Ru
B.使用催化剂 Cu/TiO2
C.增大 NH3和 O2 的初始投料比
D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)采用氨水吸收烟气中的 SO2,
①若氨水与 SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”或“碱”). 常温下弱电解质的电离平衡常数如下:氨水:Kb=1.8×10-5mol•L-1;H2SO3:Ka1=1.3×10-2mol•L-1,Ka2=6.3×10-8mol•L-1
②上述溶液中通入SO2(填“SO2”或 NH3”)气体可使溶液呈中性,此时溶液中$\frac{c{(NH}_{4}^{+})}{c(S{{O}_{3}}^{2-})}$>2(填“>”“<”或“=”)
反应 I:4NH3(g)+5O2(g)$\stackrel{PtRu}{?}$4NO(g)+6H2O(g)△H=-905.0kJ•mol-1
反应 II:4NH3(g)+3O2(g)$?_{高温}^{CU/TiO_{2}}$2N2(g)+6H2O(g)△H
(1)
| 化学键 | H-O | O=O | N≡N | N-H |
| 键能KJ•mol-1 | 463 | 496 | 942 | 391 |
(2)在恒温恒容装置中充入一定量的 NH3 和 O2,在某催化剂的作用下进行反应 I,则下 列有关叙述中正确的是A.
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内 4v 正(NH3)=6v 逆(H2O)时,说明反应已达平衡
C.当容器内 $\frac{n(NO)}{n(N{H}_{3})}$=1 时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应 I、II.为分析某催化剂对该反应的选择性,在 1L 密闭容器中充入 1mol NH3和 2mol O2,测得有关物质的量关系如图:

①该催化剂在高温时选择反应I(填“I”或“II”).
②520℃时,4NH3(g)+5O2?4NO(g)+6H2O(g)的平衡常数K=$\frac{0.{2}^{4}×0.{9}^{6}}{0.{4}^{4}×1.4{5}^{5}}$(不要求得出计算结果,只需列出数字计算式).
③有利于提高 NH3 转化为 N2 平衡转化率的措施有E
A.使用催化剂 Pt/Ru
B.使用催化剂 Cu/TiO2
C.增大 NH3和 O2 的初始投料比
D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)采用氨水吸收烟气中的 SO2,
①若氨水与 SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”或“碱”). 常温下弱电解质的电离平衡常数如下:氨水:Kb=1.8×10-5mol•L-1;H2SO3:Ka1=1.3×10-2mol•L-1,Ka2=6.3×10-8mol•L-1
②上述溶液中通入SO2(填“SO2”或 NH3”)气体可使溶液呈中性,此时溶液中$\frac{c{(NH}_{4}^{+})}{c(S{{O}_{3}}^{2-})}$>2(填“>”“<”或“=”)
19.如表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | A、B简单离子半径大小关系为B3+>A2+ | |
| B. | A、B、E对应原子的第一电离能大小为:E>A>B | |
| C. | 气态氢化物的稳定性:HD<H2C | |
| D. | 最高价氧化物对应的水化物的酸性:H2CO4>HEO4 |
6.下列事实不能说明X元素比Y元素的非金属性强的是( )
| A. | 与H2化合时X单质比Y单质容易 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | 在氧化还原反应中,甲失的电子比乙多 | |
| D. | X单质可以把Y从其氢化物中置换出来 |
16.白藜芦醇 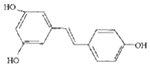 ,广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
,广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
 ,广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
,广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )| A. | 1mol,1mol | B. | 3.5mol,7mol | C. | 3.5mol,6mol | D. | 6mol,7mol |
3.X、Y、Z、W是原子序数依次增大的短周期元素,它们的最外层电子数分别为1、1、6、7.X-的电子层结构与氦相同,Y、Z和W的次外层有8个电子.下列叙述错误的是( )
| A. | 元素X、Z、W各自最高和最低化合价的代数和分别为1、4、6 | |
| B. | 原子半径的大小为Y>Z>W | |
| C. | 元素的非金属性顺序为W>Z>X | |
| D. | Y和其他3种元素均能形成离子化合物 |
20.A和B均为短周期元素,它们的离子A-和B2+具有相同的核外电子层结构.下面说法正确的是( )
| A. | 原子序数A>B | B. | 核外电子数为B>A | C. | 原子半径A>B | D. | 离子半径 B2+>A- |
1.下面是某同学完成的探究实验报告的一部分:
实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸.
实验设计如下
下列有关该实验的说法不正确的是( )
实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸.
实验设计如下
| 实验步骤 | 实验结论 |
| ①氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
| A. | 完成该实验需用到的实验仪器有试管和胶头滴管 | |
| B. | CCl4在实验中所起的作用是萃取剂 | |
| C. | ③中反应的离子方程式为Cl2+2I-═2Cl-+I2 | |
| D. | 上述三步实验能很好的探究卤素单质的氧化性强弱 |