题目内容
6.下列物质中,没有顺反异构体的是( )| A. | 2-丁烯 | B. | 1,2-二氯乙烯 | C. | 2-甲基-2-丁烯 | D. | 2-氯-2-丁烯 |
分析 存在顺反异构体的条件:(1)分子中至少有一个键不能自由旋转(否则将变成另外一种分子);(2)双键上同一碳上不能有相同的基团.
解答 解:A.2-丁烯双键上同一碳上连不相同的基团:甲基和氢原子,存在顺反异构,故A错误;
B.1,2-二氯丙烯中双键上同一碳上连有不同的基团,存在顺反异构,故B错误;
C.2-甲基-2-丁烯中双键上同一碳上连相同的基团:甲基,不具有顺反异构,故C正确;
D.2-氯-2-丁烯中双键上同一碳上连不相同的基团,存在顺反异构,故D错误;
故选C.
点评 本题考查顺反异构的判断,题目难度不大,注意掌握同分异构体的概念及类型,明确存在顺反异构体的条件为解题的关键.

练习册系列答案
相关题目
12.甲醇又称“木精”,是非常重要的化工原料.
(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇.根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学键时释放的能量)数据,写出CO(CO分子中含有C=O)和H2反应生成甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-105kJ•mol-1.
(2)甲醇脱氢可制取甲醛CH3OH(g)$\stackrel{脱氢}{?}$HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图1所示.
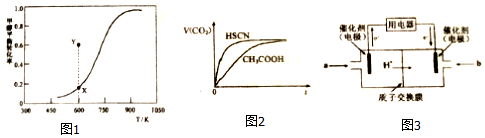
①该脱氢反应的△H>0(填“>”、“<”或“=”)
②600K时,Y点甲醇的V(正)<V(逆)(填“>”、“<”或“=”),判断依据是600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆)
③下列叙述不能说明该脱氢反应已经达到平衡状态的是AD.
A.c(CH3OH)=c(HCHO) B.HCHO的体积分数保持不变
C.V正(CH3OH)=V逆(HCHO) D.混合气体平均分子量保持不变
(3)一定条件下,甲醇与一氧化碳反应可以合成乙酸.已知:常温下,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5;Ka(HSCN)=0.13.
常温下,将20mL0.10mol•L-1CH3COOH溶液和20mL0.10mol•L-1HSCN溶液分别与20mL0.10mol•L-1NaHCO3溶液混合,实验测得产生CO2气体体积V随时间t变化的示意图如图2所示:
①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快,反应结束后所得两溶液中,C(CH3COO-)< c(SCN-)(填“>”、“<”或“=”).
②常温条件下,将amol•L-1的CH3COOH与bmol•L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为$\frac{2b}{a-2b}$×10-7L/mol.
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流.某种甲醇燃料电池工作原理如图3所示,则通入a气体电极的电极反应式为CH3OH-6e-+H2O=CO2+6H+.
(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇.根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学键时释放的能量)数据,写出CO(CO分子中含有C=O)和H2反应生成甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-105kJ•mol-1.
| 化学键 | H-H | O-H | C-H | C-O | C=O |
| 键能/KJ•mol-1 | 436 | 463 | 413 | 351 | 1076 |

①该脱氢反应的△H>0(填“>”、“<”或“=”)
②600K时,Y点甲醇的V(正)<V(逆)(填“>”、“<”或“=”),判断依据是600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆)
③下列叙述不能说明该脱氢反应已经达到平衡状态的是AD.
A.c(CH3OH)=c(HCHO) B.HCHO的体积分数保持不变
C.V正(CH3OH)=V逆(HCHO) D.混合气体平均分子量保持不变
(3)一定条件下,甲醇与一氧化碳反应可以合成乙酸.已知:常温下,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5;Ka(HSCN)=0.13.
常温下,将20mL0.10mol•L-1CH3COOH溶液和20mL0.10mol•L-1HSCN溶液分别与20mL0.10mol•L-1NaHCO3溶液混合,实验测得产生CO2气体体积V随时间t变化的示意图如图2所示:
①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快,反应结束后所得两溶液中,C(CH3COO-)< c(SCN-)(填“>”、“<”或“=”).
②常温条件下,将amol•L-1的CH3COOH与bmol•L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为$\frac{2b}{a-2b}$×10-7L/mol.
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流.某种甲醇燃料电池工作原理如图3所示,则通入a气体电极的电极反应式为CH3OH-6e-+H2O=CO2+6H+.
13.绿原酸是从金银花中提取出的有很高药用价值的有机物,其结构如图所示,下列说法正确的是( )
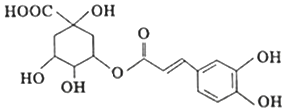

| A. | 绿原酸分子中有4种含氧官能团 | |
| B. | 绿原酸能发生取代、加成、消去和氧化反应 | |
| C. | 绿原酸在酸性条件下的水解产物均能与FeCl3发生显色反应 | |
| D. | l mol绿原酸与足量钠反应,可生成4 molH2 |
14.利用如图所示装置可制取 H2,两个电极均为惰性电极,c 为阴离子交换膜.下列叙述正确的是( )

| A. | a 为电源的正极 | |
| B. | 工作时,OH-向左室迁移 | |
| C. | 右室电极反应为:C2H5OH+H2O-4e-═CH3COO-+5H+ | |
| D. | 生成 H2 和 CH3COONa 的物质的量之比为 2:1 |
1.已知An+、B(n+1)+、Cn-、D(n+1)-具有相同的电子层结构.下列关于A、B、C、D四种元素的叙述中正确的是( )
| A. | 气态氢化物的稳定性:D>C | |
| B. | 原子序数:B>A>C>D | |
| C. | 最高价氧化物对应水化物的碱性:B>A | |
| D. | 四种元素一定都属于短周期元素 |
11.下列关于有机化合物的说法正确的是( )
| A. | 1mol的  与足量的NaOH溶液反应,能消耗3mol NaOH 与足量的NaOH溶液反应,能消耗3mol NaOH | |
| B. | 可用氢氧化钠溶液除去乙酸乙酯中残留的乙酸 | |
| C. | 间二甲苯也叫1,5-二甲苯 | |
| D. | 乙二醇和丙三醇互为同系物 |
15.柠檬酸是常见的食品添加剂,其结构式如图所示.以下叙述正确的是( )


| A. | 柠檬酸分子式为C6H9O7 | |
| B. | 使用食品添加剂属于违法行为 | |
| C. | 柠檬酸可用作食品抗氧化剂,说明其有较强氧化性 | |
| D. | 柠檬酸分子含三个羧基(-COOH) |
16.白藜芦醇 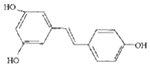 ,广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
,广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
 ,广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
,广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )| A. | 1mol,1mol | B. | 3.5mol,7mol | C. | 3.5mol,6mol | D. | 6mol,7mol |
 $\stackrel{铑催化剂}{→}$
$\stackrel{铑催化剂}{→}$ (R1代表氢原子或烃基)
(R1代表氢原子或烃基)
 +
+ $\stackrel{碱}{→}$
$\stackrel{碱}{→}$ +H2O
+H2O .
.