题目内容
9. 利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池并写出电极反应式画出示意图.
利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池并写出电极反应式画出示意图.正极材料:不如Cu活泼的金属或导电的非金属石墨等;
负极材料:Cu;
电解质溶液:氯化铁溶液.
负极反应:Cu-2e-=Cu2+;
正极反应:2Fe3++2e-=2Fe2+.
分析 该反应中Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,所以Cu发生氧化反应、氯化铁发生还原反应,根据原电池原理知,Cu为负极、不如Cu活泼的金属或导电的非金属性作正极,氯化铁溶液为电解质溶液,据此设计原电池.
解答 解:该反应中Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,所以Cu发生氧化反应、氯化铁发生还原反应,根据原电池原理知,负极材料为Cu、不如Cu活泼的金属或导电的非金属作正极材料,氯化铁溶液为电解质溶液,可以选取石墨作正极,负极反应为:Cu-2e-=Cu2+,正极反应为:2Fe3++2e-=2Fe2+,总反应:2Fe3++Cu=Cu2++2Fe2+,装置图为 ,
,
故答案为:不如Cu活泼的金属或导电的非金属石墨等;Cu;氯化铁溶液;Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+; .
.
点评 本题考查原电池设计,为高频考点,把握原电池的工作原理、电极反应、电极材料等为解答的关键,侧重分析与实验能力的考查,注意正极材料的选择,题目难度不大.

练习册系列答案
相关题目
15.下列反应是吸热反应的是( )
| A. | 灼热的炭与氧气碳反 应 | |
| B. | 铁和稀硫酸的反应 | |
| C. | 氢氧化钡晶体的粉末和氯化铵晶体混合 | |
| D. | 钢铁制品生锈的反应 |
16.W、X、Y、Z为原子序数依次增大的短周期元素,X、Y、Z同周期且相邻.由上述四种元素组成的化合物分解生成三种产物,其中两种气体产物的水溶液酸碱性相反.下列说法正确的是( )
| A. | 原子半径:W<X<Y<Z | |
| B. | 最高价氧化物对应水化物酸性:X>Y | |
| C. | W、X两种元素组成的化合物难溶于水 | |
| D. | W、Y、Z三种元素不能组成离子化合物 |
13.绿原酸是从金银花中提取出的有很高药用价值的有机物,其结构如图所示,下列说法正确的是( )
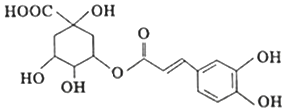

| A. | 绿原酸分子中有4种含氧官能团 | |
| B. | 绿原酸能发生取代、加成、消去和氧化反应 | |
| C. | 绿原酸在酸性条件下的水解产物均能与FeCl3发生显色反应 | |
| D. | l mol绿原酸与足量钠反应,可生成4 molH2 |
4.下列叙述正确的是( )
| A. | △H>0的反应,升高温度v正增大,v逆减小,平衡向正反应方向移动 | |
| B. | 若化学平衡移动了,但正、逆反应不一定都变化 | |
| C. | 正、逆反应速率都变化了,化学平衡必发生移动 | |
| D. | 石墨吸收能量后可转化为金刚石,说明金刚石比石墨稳定 |
14.利用如图所示装置可制取 H2,两个电极均为惰性电极,c 为阴离子交换膜.下列叙述正确的是( )

| A. | a 为电源的正极 | |
| B. | 工作时,OH-向左室迁移 | |
| C. | 右室电极反应为:C2H5OH+H2O-4e-═CH3COO-+5H+ | |
| D. | 生成 H2 和 CH3COONa 的物质的量之比为 2:1 |
1.已知An+、B(n+1)+、Cn-、D(n+1)-具有相同的电子层结构.下列关于A、B、C、D四种元素的叙述中正确的是( )
| A. | 气态氢化物的稳定性:D>C | |
| B. | 原子序数:B>A>C>D | |
| C. | 最高价氧化物对应水化物的碱性:B>A | |
| D. | 四种元素一定都属于短周期元素 |
19.如表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | A、B简单离子半径大小关系为B3+>A2+ | |
| B. | A、B、E对应原子的第一电离能大小为:E>A>B | |
| C. | 气态氢化物的稳定性:HD<H2C | |
| D. | 最高价氧化物对应的水化物的酸性:H2CO4>HEO4 |
 $\stackrel{铑催化剂}{→}$
$\stackrel{铑催化剂}{→}$ (R1代表氢原子或烃基)
(R1代表氢原子或烃基)
 +
+ $\stackrel{碱}{→}$
$\stackrel{碱}{→}$ +H2O
+H2O .
.