题目内容
7.当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是( )| A. | 当电池负极消耗mg气体时,电解池阳极同时有mg气体生成 | |
| B. | 电池的正极反应式为:4OH--4e-=O2↑+2H2O | |
| C. | 电解后c(Na2CO3)不变,且溶液中有晶体析出 | |
| D. | 电池中c(KOH)不变;电解池中溶液pH变大 |
分析 该燃料电池为碱性电池,电池的正极反应为:O2+2H2O+4e-═4OH-,负极反应为:H2-2e-+2OH-═H2O,电解饱和碳酸钠溶液阴极发生的反应为:2H++2e-═H2↑,阳极反应为:4OH--4e-═O2↑+2H2O,
A.负极上氢气失电子和氢氧根离子生成水,阳极上氢氧根离子放电生成氧气,根据电子守恒计算;
B.正极上氧气得电子和水反应生成氢氧根离子;
C.电解时,阳极上氢氧根离子放电、阴极上氢离子放电,实际上是电解水,导致析出部分碳酸钠,溶液仍然是饱和溶液;
D.放电时,原电池中生成水,氢氧化钾的物质的量不变,据此确定其浓度是否变化;电解池中碳酸钠浓度不变,其pH不变.
解答 解:A.电池负极反应为:H2-2e-+2OH-═H2O,当负极消耗mg气体时,转移的电子的物质的量为 $\frac{m}{2}$mol×2=mmol,电解池阳极得电子为 m mol,阳极发生的反应为:4OH--4e-═O2↑+2H2O,阳极生成气体的质量为:$\frac{m}{4}$mol×32g/mol=8mg,故A错误;
B.该燃料电池为碱性电池,电池的正极反应为:O2+2H2O+4e-═4OH-,故B错误;
C.电解后,由于电解了水,水的质量减小,碳酸钠为饱和溶液,所以会析出碳酸钠晶体,但是仍然为碳酸钠饱和溶液,则c(Na2CO3)不变,故C正确;
D.放电时燃料电池的总反应为O2+2H2═2H2O,原电池中生成水,氢氧化钾的物质的量不变,则氢氧化钾浓度降低;电解池中碳酸钠浓度不变,其pH不变,故D错误;
故选C.
点评 本题考查了原电池原理和电解池工作原理,题目难度中等,明确电解反应实质为解答关键,注意电解后的碳酸钠溶液仍然是饱和溶液,导致其浓度、pH都不变,为易错点,试题培养了学生的分析能力及灵活应用能力..

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案| A. | 若X为IA族时,Y不可能是第三周期VIA族元素 | |
| B. | 由X、Y、Z、W四种元素不可能形成其原子个数比为1:3:1:1的化合物 | |
| C. | Z元素的原子半径一定小于W元素的原子半径 | |
| D. | 若X为IVA族元素时,X、Y两元素可形成含有共价键的离子化合物 |
| A. | 铜、铁、铝 | B. | 铁、铝、铜 | C. | 铝、铜、铁 | D. | 铁、铜、铝 |
| A. | 热的纯水 | B. | 热的烧碱 | C. | 冷的浓硫酸 | D. | 冷的硫酸铜溶液 |
| A. | 在溶有1molFe(OH)3胶粒的胶体中,含有多于NA个的Fe(OH)3分子 | |
| B. | 将一束强光通过淀粉溶液,也能产生丁达尔效应 | |
| C. | “雨后彩虹”“海市蜃楼”既是一种自然现象又是光学现象,也与胶体的知识有关 | |
| D. | 纳米材料粒子直径一般从几纳米到几十纳米,因此纳米材料属于胶体 |
| 实验编号 | c(HA)/mol•L-1) | c(NaOH)/mol•L-1 | 混合后溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=c |
| A. | 甲中:若a=7,则HA是强酸 | |
| B. | 乙中:若b≠0.2,则c(A-)=C(Na+) | |
| C. | 丙中:若HA是弱酸,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$<1 | |
| D. | 丁中:若 c=9,则c(OH-)-c(HA)=10-9mol/L |
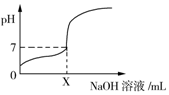 常温下,用0.1mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是( )
常温下,用0.1mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是( )| A. | X=20 | |
| B. | HA溶液加水稀释后,溶液中$\frac{c(HA)}{{c({A^-})}}$的值减小 | |
| C. | 0.1 mol/L的NaOH溶液中,由水电离出的c(OH-)=0.1 mol/L | |
| D. | 加入NaOH溶液体积为X mL时,溶液中c(A-)=0.05 mol/L |
| A. | 泡沫灭火器中用的是苏打和硫酸铝 | |
| B. | 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 | |
| C. | 理想的催化剂可以大幅度提高目标产物在最终产物的比率 | |
| D. | Na与H2O的反应是熵减的放热反应,该反应能自发进行 |
| A. | 2-氯丁烷与氢氧化钠、乙醇在加热条件下的消去反应 | |
| B. | 乙烯通入溴水中的加成反应 | |
| C. | 灼热的铜丝插入足量乙醇中的氧化反应 | |
| D. | 苯酚与足量的氢气在一定条件下的加成反应 |