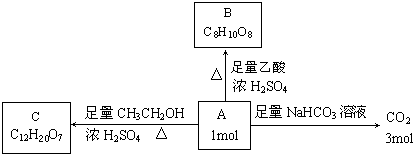
题目内容
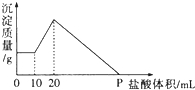 将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:求:
将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:求:(1)分别求混合物中AlCl3、MgCl2物质的量
(2)P点时加入HCl的体积(要求写出计算过程)
考点:有关混合物反应的计算,镁、铝的重要化合物
专题:
分析:将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中加入盐酸时,0-10mL时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子,白色沉淀为Mg(OH)2,根据Mg元素守恒:n(MgCl2)=n[Mg(OH)2];
加入盐酸10-20mL,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为:H2O+AlO2-+H+=Al(OH)3↓,沉淀最大时,溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3,根据离子方程计算n[Al(OH)3],再根据Al元素守恒计算n(AlCl3);
加入20-PmL盐酸,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,溶液中的溶质是氯化铝、氯化镁和氯化钠,P点所加盐酸用于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)=n(NaOH),沉淀最大时,溶液中存在的溶质是氯化钠,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl),进而计算P点加入盐酸的体积.
加入盐酸10-20mL,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为:H2O+AlO2-+H+=Al(OH)3↓,沉淀最大时,溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3,根据离子方程计算n[Al(OH)3],再根据Al元素守恒计算n(AlCl3);
加入20-PmL盐酸,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,溶液中的溶质是氯化铝、氯化镁和氯化钠,P点所加盐酸用于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)=n(NaOH),沉淀最大时,溶液中存在的溶质是氯化钠,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl),进而计算P点加入盐酸的体积.
解答:
解:将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中加入盐酸时,0-10mL时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子,白色沉淀为Mg(OH)2,加入盐酸10-20mL,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为:H2O+AlO2-+H+=Al(OH)3↓,沉淀最大时,溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3,加入20-PmL盐酸,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,溶液中的溶质是氯化铝、氯化镁和氯化钠,
(1)发生反应:H2O+AlO2-+H+=Al(OH)3↓,消耗盐酸体积为20mL-10mL=10mL=0.01L,故n[Al(OH)3]=n(H+)=0.01L×0.5mol/L=0.005mol,根据Al元素守恒:n(AlCl3)=n[Al(OH)3]=0.005mol
根据Mg元素守恒:n(MgCl2)=n[Mg(OH)2]=
=0.01mol;
答:AlCl3的物质的量为0.005mol;MgCl2物质的量为0.01mol;
(2)P点所加盐酸用于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)=n(NaOH),沉淀最大时,溶液中存在的溶质是氯化钠,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.005mol×3+0.02L×0.5mol/L=0.045mol,
故P点加入盐酸的体积为
=0.09L=90mL,
答:P点时加入HCl的体积90mL.
(1)发生反应:H2O+AlO2-+H+=Al(OH)3↓,消耗盐酸体积为20mL-10mL=10mL=0.01L,故n[Al(OH)3]=n(H+)=0.01L×0.5mol/L=0.005mol,根据Al元素守恒:n(AlCl3)=n[Al(OH)3]=0.005mol
根据Mg元素守恒:n(MgCl2)=n[Mg(OH)2]=
| 0.58g |
| 58g/mol |
答:AlCl3的物质的量为0.005mol;MgCl2物质的量为0.01mol;
(2)P点所加盐酸用于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)=n(NaOH),沉淀最大时,溶液中存在的溶质是氯化钠,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.005mol×3+0.02L×0.5mol/L=0.045mol,
故P点加入盐酸的体积为
| 0.045mol |
| 0.5mol/L |
答:P点时加入HCl的体积90mL.
点评:本题乙化学反应图象形式考查混合物计算,明确各解得发生的反应是关键,综合考查学生分析计算能力,注意利用守恒进行的解答,难度中等.

练习册系列答案
相关题目
铜与人体分泌物中的盐酸以及空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)即是一种弱酸也是一种自由基,具有极高的活性.下列说法或表示正确的是( )
| A、氧化产物是HO2 |
| B、HO2在碱中能稳定存在 |
| C、氧化剂是O2 |
| D、1 mol Cu参加反应有2 mol电子发生转移 |
下列实验操作,正确的是( )
| A、中和滴定时,用标准液润洗滴定管,用待测液润洗锥形瓶,并滴入l mL指示剂 |
| B、配制物质的量浓度溶液时,将称量好的溶质溶于盛有适量水的烧杯中,溶解后立即倾入容量瓶中,继续进行洗涤和定容 |
| C、制取Fe(OH)2时,吸取NaOH溶液的胶头滴管的末端应插入FeSO4溶液中,再缓缓将NaOH溶液挤出 |
| D、溴乙烷和烧碱溶液共热后,将硝酸银溶液滴入水解液中,即可见到淡黄色沉淀 |
用四氯化碳萃取碘水中的碘,下列说法中不正确的是( )
| A、实验中使用的主要仪器是分液漏斗 |
| B、碘在四氯化碳中的溶解度比在水中的溶解度大 |
| C、不可把萃取剂四氯化碳换成酒精 |
| D、分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从分液漏斗上口倒出 |