题目内容
一定温度下,将3mol A气体和1mol B气体通人一密闭容器中,发生如下反应:3A(g)+B(g)?xC(g).请填写下列空白:若容器体积固定为2L,反应进行到2min末,测得剩余0.6mol B,C的浓度为0.6mol/L.
①2min末,A的浓度为 ;以B浓度变化表示的反应速率为 ;
②x= ;
③若反应经4min达到平衡,平衡时C的浓度 1.2mol/L (填“大于”、“等于”或“小于”).
①2min末,A的浓度为
②x=
③若反应经4min达到平衡,平衡时C的浓度
考点:化学平衡的计算
专题:
分析:①计算出反应前A、B的浓度及剩余B的浓度,再根据B的浓度变化计算出2min末时A的浓度;根据反应速率的表达式v=
计算出以B浓度变化表示的反应速率;
②根据B、C的浓度变化计算出二者计量数之比,从而计算出x值;
③根据浓度越小,反应速率越慢判断平衡时C的浓度大小.
| △c |
| △t |
②根据B、C的浓度变化计算出二者计量数之比,从而计算出x值;
③根据浓度越小,反应速率越慢判断平衡时C的浓度大小.
解答:
解:①反应前A的物质的量浓度为:c(A)=
=1.5mol/L,
B的浓度变化为:c(B)=
=0.2mol/L,
根据化学计量数关系可知,2min时A的浓度变化为:0.2mol/L×
=0.6mol/L,
则2min末A的浓度为:1.5mol/L-0.6mol/L=0.9mol/L,
则2min内用B表示的反应速率为:v(B)=
=0.1mol/(L?min),
故答案为:0.9mol/L;0.1mol/(L?min);
②B、C的浓度变化与化学计量数成正比,则:1:x=0.2mol/L:0.6mol/L,
解得:x=3,
故答案为:3;
③应进行到2min末,C的浓度为0.6mol/L,由于随着反应的进行,反应物浓度减小,则反应速率减小,所以反应经4min达到平衡时,C的浓度小于2min时浓度的2倍,即小于1.2mol/L,
故答案为:小于.
| 3mol |
| 2L |
B的浓度变化为:c(B)=
| 1mol-0.6mol |
| 2L |
根据化学计量数关系可知,2min时A的浓度变化为:0.2mol/L×
| 3 |
| 1 |
则2min末A的浓度为:1.5mol/L-0.6mol/L=0.9mol/L,
则2min内用B表示的反应速率为:v(B)=
| 0.2mol/L |
| 2min |
故答案为:0.9mol/L;0.1mol/(L?min);
②B、C的浓度变化与化学计量数成正比,则:1:x=0.2mol/L:0.6mol/L,
解得:x=3,
故答案为:3;
③应进行到2min末,C的浓度为0.6mol/L,由于随着反应的进行,反应物浓度减小,则反应速率减小,所以反应经4min达到平衡时,C的浓度小于2min时浓度的2倍,即小于1.2mol/L,
故答案为:小于.
点评:本题考查了化学平衡的计算,题目难度中等,注意掌握化学反应速率、化学平衡的概念及计算方法,明确化学计量数与化学反应速率的关系,试题侧重基础知识的考查,有利于培养学生的化学计算能力.

练习册系列答案
相关题目
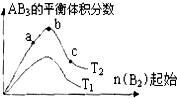 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是( )
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是( )| A、达到平衡时A2的转化率大小为:c>b>a |
| B、a、b、c三点的平衡常数相同 |
| C、该反应一定是放热反应,且T2<T1 |
| D、b点时,平衡体系中A、B原子数之比一定是1:1 |
关于乙醇和乙酸的下列说法中正确的是( )
| A、它们都能与金属钠反应放出氢气,说明它们都是电解质 |
| B、它们都能发生酯化反应,反应中的断键位置也相同 |
| C、除去乙醇中的乙酸可加生石灰后再蒸馏 |
| D、用酸性K2Cr2O7检验司机是否酒后驾车,是利用了乙醇的氧化性 |
已知反应A2(g)+2B2(g)?2AB2(g)的△H<0,下列说法正确的( )
| A、升高温度有利于反应速率增加,从而缩短达到平衡的时间升高温度 |
| B、正向反应速率增加,逆向反应速率减小 |
| C、达到平衡后,升高温度,平衡向正反应方向移动 |
| D、达到平衡后,减小压强,平衡向正反应方向移动 |
 用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)
用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.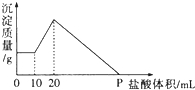 将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:求:
将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:求: