题目内容
现有下列状态的物质①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液⑥铜 ⑦熔融的KOH ⑧蔗糖,
其中属于电解质的是 ,属于非电解质的是
(l)写出FeCl3的电离方程式: ,
(2)写出NaHCO3(aq) 与稀盐酸反应的离子方程式: ,
(3)胶体是一种常见的分散系,回答下列问题.
①向煮沸的蒸馏水中逐滴加入 溶液,继续煮沸至 ,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为 .
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于 离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做 .
③区分胶体和溶液常用的方法叫做 .
其中属于电解质的是
(l)写出FeCl3的电离方程式:
(2)写出NaHCO3(aq) 与稀盐酸反应的离子方程式:
(3)胶体是一种常见的分散系,回答下列问题.
①向煮沸的蒸馏水中逐滴加入
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于
③区分胶体和溶液常用的方法叫做
考点:电解质与非电解质,离子方程式的书写,胶体的重要性质
专题:
分析:在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质;
(1)FeCl3为强电解质,完全电离;
(2)NaHCO3(aq) 与稀盐酸反应生成氯化钠、水和二氧化碳;
(3)①根据Fe(OH)3胶体的制备过程进行判断;
②根据胶体的性质进行分析;
③根据胶体与溶液性质的区别进行解答;
(1)FeCl3为强电解质,完全电离;
(2)NaHCO3(aq) 与稀盐酸反应生成氯化钠、水和二氧化碳;
(3)①根据Fe(OH)3胶体的制备过程进行判断;
②根据胶体的性质进行分析;
③根据胶体与溶液性质的区别进行解答;
解答:
解:②④⑦在水溶液里或熔融状态下能电离出阴阳离子而使其水溶液或熔融状态导电,所以属于电解质;
①的水溶液能电离出阴阳离子的是碳酸,所以二氧化碳是非电解质,⑧蔗糖在水溶液里或熔融状态下以分子存在,所以其水溶液或熔融状态不导电,为非电解质;
故答案为:②④⑦;①⑧;
(1)FeCl3为强电解质,完全电离,电离方程式为FeCl3═Fe3++3Cl-,
故答案为:FeCl3═Fe3++3Cl-;
(2)反应生成氯化钠、水和二氧化碳,离子反应为HCO3-+H+=H2O+CO2↑,
故答案为:HCO3-+H+=H2O+CO2↑;
(3)①Fe(OH)3胶体的制备过程:向煮沸的蒸馏水中逐滴加入FeCl3饱和溶液;继续煮沸至溶液呈红褐色,FeCl3+3H2O(沸水)
Fe(OH)3(胶体)+3HCl,停止加热,可制得Fe(OH)3胶体,
故答案为:饱和FeCl3溶液;溶液呈红褐色;FeCl3+3H2O(沸水)
Fe(OH)3(胶体)+3HCl;
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于硫酸根离子中和了氢氧化铁胶粒的电荷,导致胶体发生了聚沉,
故答案为:SO42-;胶体的聚沉;
③胶体具有丁达尔效应,据此可以区分胶体和溶液,胶体的丁达尔效应是胶体粒子对光线的散射作用形成的,
故答案为:丁达尔效应;
①的水溶液能电离出阴阳离子的是碳酸,所以二氧化碳是非电解质,⑧蔗糖在水溶液里或熔融状态下以分子存在,所以其水溶液或熔融状态不导电,为非电解质;
故答案为:②④⑦;①⑧;
(1)FeCl3为强电解质,完全电离,电离方程式为FeCl3═Fe3++3Cl-,
故答案为:FeCl3═Fe3++3Cl-;
(2)反应生成氯化钠、水和二氧化碳,离子反应为HCO3-+H+=H2O+CO2↑,
故答案为:HCO3-+H+=H2O+CO2↑;
(3)①Fe(OH)3胶体的制备过程:向煮沸的蒸馏水中逐滴加入FeCl3饱和溶液;继续煮沸至溶液呈红褐色,FeCl3+3H2O(沸水)
| ||
故答案为:饱和FeCl3溶液;溶液呈红褐色;FeCl3+3H2O(沸水)
| ||
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于硫酸根离子中和了氢氧化铁胶粒的电荷,导致胶体发生了聚沉,
故答案为:SO42-;胶体的聚沉;
③胶体具有丁达尔效应,据此可以区分胶体和溶液,胶体的丁达尔效应是胶体粒子对光线的散射作用形成的,
故答案为:丁达尔效应;
点评:本题考查了电解质、非电解质的概念、离子反应方程式的书写、胶体的制备及性质,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握,题目难度不大.注意掌握胶体的制备方法、胶体的性质及鉴别方法,明确电解质与非电解质的区别.

练习册系列答案
相关题目
下列有水参与或生成的反应不属于取代反应的是( )
| A、CH2═CH2+H2O→CH3CH2OH | |||
B、
 | |||
C、CH3COOH+HOCH2CH3
| |||
D、CH3CH2Cl+H2O
|
用惰性电极电解下列物质的溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全相同的是( )
| A、CuCl2[CuO] |
| B、NaOH[Na2O] |
| C、NaCl[HCl] |
| D、CuSO4[Cu(OH)2] |
常温下,关于下列各溶液的叙述正确的是( )
| A、pH>7的醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c(Na+) |
| B、0.1mol/L稀醋酸pH=a,0.01mol/L的稀醋酸pH=b,则a+1=b |
| C、0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性:c(CH3COOH)-c(CH3COO-)=2[c(OH-)-c(H+)] |
| D、已知酸性HF>CH3COOH,pH相等的NaF溶液与CH3COOK溶液中:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)] |
已知反应A2(g)+2B2(g)?2AB2(g)的△H<0,下列说法正确的( )
| A、升高温度有利于反应速率增加,从而缩短达到平衡的时间升高温度 |
| B、正向反应速率增加,逆向反应速率减小 |
| C、达到平衡后,升高温度,平衡向正反应方向移动 |
| D、达到平衡后,减小压强,平衡向正反应方向移动 |
下列离子方程式的书写正确的是( )
| A、足量铁粉与稀硝酸反应:Fe+4H++NO3-=Fe3++2H2O+NO↑ |
| B、将少量SO2气体通入NaClO溶液中:SO2+ClO-+H2O=SO32-+2HClO |
| C、硫酸溶液中加入足量氢氧化钡溶液:Ba2++OH-+H++SO42-=BaSO4+H2O |
| D、向Mg(OH)2浊液中滴入FeCl3溶液:3 Mg(OH)2(s)+2 Fe3+?2 Fe(OH)3(s)+3Mg2+ |
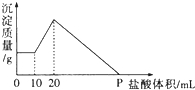 将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:求:
将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:求: