题目内容
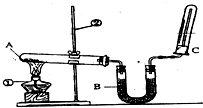 某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题:
某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题:(1)配制100mL1mol/L的NH4Cl溶液.该同学应用托盘天平称量NH4Cl固体的质量为
现有以下仪器:烧杯、胶头滴管、玻璃棒等玻璃仪器.
①还缺少的仪器有
②使用容量瓶前必须进行的一步操作是
(2)该同学又用如图所示的装置做了有关氨气的性质实验.
①写出实验室制氨气的化学方程式:
②B中盛放碱石灰的作用是
③氨气极易溶于水,在氨水中滴加酚酞试液的现象是:
④检验氨气的方法是
考点:性质实验方案的设计
专题:
分析:(1)根据溶液的浓度和体积计算物质的量,在计算质量;
①根据实验步骤分析;
②带有玻璃塞的仪器均需要检漏;
(2)①实验室用氢氧化钙和氯化铵加热制氨气;
②碱石灰常用作干燥剂;
③氨气溶于水显碱性;
④氨气能使湿润的红色石蕊试纸变蓝,氨气与氯化氢结合生成氯化铵固体.
①根据实验步骤分析;
②带有玻璃塞的仪器均需要检漏;
(2)①实验室用氢氧化钙和氯化铵加热制氨气;
②碱石灰常用作干燥剂;
③氨气溶于水显碱性;
④氨气能使湿润的红色石蕊试纸变蓝,氨气与氯化氢结合生成氯化铵固体.
解答:
解:(1)配制100mL1mol/L的NH4Cl溶液,则n=cV=0.1L×1mol/L=0.1mol,则其质量为0.1mol×53.5g/mol=5.35g,托盘天平称精确到0.1g,则用托盘天平称量NH4Cl固体的质量为5.4g;
故答案为:5.4;
①配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加.
所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、100容量瓶、胶头滴管;
故答案为:100容量瓶;
②带有玻璃塞的仪器均需要检漏,所以在使用容量瓶配制溶液必须进行的一步操作是检查是否漏水;
故答案为:检查是否漏水;
(2)①实验室用氢氧化钙和氯化铵加热生成氨气、氯化钙和水,其反应的方程式为:Ca(OH)2+NH4Cl
CaCl2+2NH3↑+2H2O;
故答案为:Ca(OH)2+NH4Cl
CaCl2+2NH3↑+2H2O;
②碱石灰常用作干燥剂,则B中盛放碱石灰的作用是作干燥剂吸收水蒸气,
故答案为:吸收水蒸气;
③氨气溶于水生成一水合氨,溶液显碱性,则在氨水中滴加酚酞试液的现象是溶液由无色变为红色;
故答案为:溶液由无色变为红色;
④氨气能使湿润的红色石蕊试纸变蓝,则可以用湿润的红色石蕊试纸检验氨气,氨气与氯化氢结合生成氯化铵固体,则氨气遇到蘸有浓盐酸的玻璃棒会产生白烟;
故答案为:用湿润的红色石蕊试纸 或蘸有浓盐酸的玻璃棒.
故答案为:5.4;
①配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加.
所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、100容量瓶、胶头滴管;
故答案为:100容量瓶;
②带有玻璃塞的仪器均需要检漏,所以在使用容量瓶配制溶液必须进行的一步操作是检查是否漏水;
故答案为:检查是否漏水;
(2)①实验室用氢氧化钙和氯化铵加热生成氨气、氯化钙和水,其反应的方程式为:Ca(OH)2+NH4Cl
| ||
故答案为:Ca(OH)2+NH4Cl
| ||
②碱石灰常用作干燥剂,则B中盛放碱石灰的作用是作干燥剂吸收水蒸气,
故答案为:吸收水蒸气;
③氨气溶于水生成一水合氨,溶液显碱性,则在氨水中滴加酚酞试液的现象是溶液由无色变为红色;
故答案为:溶液由无色变为红色;
④氨气能使湿润的红色石蕊试纸变蓝,则可以用湿润的红色石蕊试纸检验氨气,氨气与氯化氢结合生成氯化铵固体,则氨气遇到蘸有浓盐酸的玻璃棒会产生白烟;
故答案为:用湿润的红色石蕊试纸 或蘸有浓盐酸的玻璃棒.
点评:本题考查了溶液的配制、物质的量的计算、方程式的书写、物质的检验等,侧重于考查学生的实验能力和对基础知识的综合应用能力,题目难度中等.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
电离常数(Ka和Kb)、溶度积常数(Ksp)是判断物质性质的重要常数,下列关于这些常数的运算或运用正确的是( )
| A、某亚硫酸溶液pH=4.3,若忽略二级电离,则其一级电离平衡常数K1=1.0×l0-8.60 |
| B、Ka( HCN)<Ka( CH3COOH).说明同浓度时氢氰酸的酸性比醋酸强 |
| C、Ksp( AgI)<Ksp( AgCl),向AgCl悬浊液中加入KI溶液会出现黄色沉淀 |
| D、Ksp( AgBr)<Ksp( AgCl),说明AgBr和AgCl均不溶于稀硝酸 |
在相同温度下,先在1L密闭容器中充入1mol H2(g)和1mol 的I2(g),发生反应 H2(g)+I2(g)?2HI(g);再在2L的另一密闭容器中充入1mol HI(g),发生反应:HI(g)?
H2(g)+
I2(g),达到平衡时,两容器中HI的体积分数为50%,则两者的平衡常数( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、前者大 | B、前者小 |
| C、相等 | D、无法比较 |
下列说法正确的是( )
| A、色谱法通常用于分离结构相近、物理性质和化学性质相似的物质,气相色谱法就是其中一种 |
| B、抽滤完成后若要洗涤沉淀,可以向布氏漏斗中直接加洗涤剂,然后开大水龙头,使洗涤剂迅速通过沉淀 |
| C、提取海带中碘元素时,为保证I-完全被氧化为I2,最好加入过量的氧化剂(H2O2或新制氯水) |
| D、将两块未擦去氧化膜的铝片分别投入1mol?L-1CuSO4溶液、1mol?L-1CuCl2溶液中,静置片刻,铝片表面都观察不到明显的反应现象 |
下列鉴别方法不可行的是( )
| A、用光照的方法鉴别硫酸铜溶液和氢氧化铁胶体 |
| B、用稀硫酸来鉴别BaCl2、NaCl、Na2CO3三种溶液 |
| C、用BaCl2溶液和稀硝酸来鉴别Na2SO4和AgNO3两种溶液 |
| D、用CCl4来鉴别FeCl3溶液和碘水 |
在相同温度和体积均为1L的三个密闭容器中,保持温度和容积不变,以三种不同的投料方式进行反应,平衡时有关数据如下(已知相同条件下2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol),下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 起始投入量 | 2mol SO2和1mol O2 | 2mol SO3 | 2mol SO2和2mol O2 |
| 反应放出或吸收的 热量(kJ) | Q1 | Q2 | Q3 |
| 平衡时SO3的物质的量 | n1 | n2 | n3 |
| 平衡转化率 | |||
| 平衡时压强 | p1 | p2 | p3 |
| A、Q1=Q2>Q3 |
| B、n2>n1>n3 |
| C、a1+a2=1 |
| D、p1>p2>p3 |
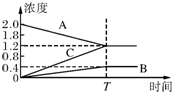 如图的曲线是800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是平衡的时间,能以此曲线表示的反应是( )
如图的曲线是800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是平衡的时间,能以此曲线表示的反应是( )| A、2A?B+3C |
| B、B+3C?2A |
| C、A+C?B |
| D、B?A+C |
 试回答下列问题:
试回答下列问题: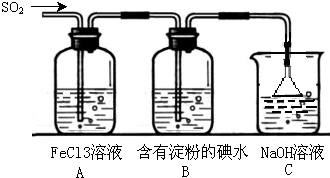 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示: