题目内容
3.下列物质中:①N2、②MgCl2、③NH4Cl、④ZnSO4、⑤CO2、⑥HClO4、⑦KOH、⑧H3PO4(填编号)
(1)属于非电解质的是⑤;属于弱电解质的是⑧.
(2)属于共价化合物的是⑤⑥⑧;不含有共价键的离子化合物是②.
(3)既含有离子键又含有共价键的是③④⑦.
分析 (1)电解质:在水溶液中或熔融状态下能够导电的化合物,非电解质:在熔融状态和水溶液中都不能导电的化合物;
(2)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物属于离子化合物,只含有共价键的化合物属于共价化合物;
(3)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物.
解答 解:(1)⑤CO2 本身不能电离属于非电解质,⑧H3PO4水溶液中部分电离属于弱电解质,
故答案为:⑤;⑧;
(2)属于共价化合物的是⑤CO2、⑥HClO4、⑧H3PO4,属于离子化合物的为:②MgCl2、③NH4Cl、④ZnSO4、⑦KOH,其中不含有共价键的离子化合物是②,
故答案为:⑤⑥⑧;②;
(3)既含有离子键又含有共价键的是③④⑦,
故答案为:③④⑦.
点评 本题考查电解质、非电解质概念的辨析、离子化合物和共价化合物的区别、离子键和共价键的判断,题目难度不大.解题时紧抓住电解质必须是化合物,以及导电是在水溶液或熔化状态下为条件,弱电解质存在电离平衡.

练习册系列答案
相关题目
13.将14g铜银合金与足量的HNO3反应,将产生的气体与1.12L O2(标准状况下)混合后,通入水中,恰好被全部吸收,则合金中Ag的质量为( )
| A. | 3.2 g | B. | 4.8 g | C. | 6.4 g | D. | 10.8 g |
11.下列反应中,不属于可逆反应的是( )
| A. | 2NO2=N2O4与N2O4=2NO2 | |
| B. | H2+I2$\frac{\underline{\;\;△\;\;}}{\;}$2HI与2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2+I2 | |
| C. | CO2+H2O=H2CO3与 H2CO3=CO2↑+H2O | |
| D. | CaO+CO2=CaCO3与CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
18.用NA表示阿伏加德罗常数,下列叙述不正确的是( )
| A. | 常温常压下,7.8 gNa2O2含有的Na+数为0.2NA | |
| B. | 标准状况下,22.4 LCl2与水充分反应,转移的电子数为NA | |
| C. | 标准状况下,NA个CO2与SO2的混合气体分子占有的体积约为22.4 L | |
| D. | 50℃、1×105Pa下6g NO2与0℃、2×105 Pa下46 g N2O4均含有3NA个原子 |
12.已知X、Y是主族元素,I为电离能,单位是kJ•mol-1.请根据下表所列数据判断,错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 780 | 1300 | 2100 | 11600 |
| A. | 若元素Y处于第三周期,它可与冷水剧烈反应 | |
| B. | 元素X的常见化合价是+1 | |
| C. | 元素Y是ⅢA族元素 | |
| D. | 元素X与氯形成化合物时,化学式可能是XCl |
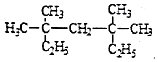 系统命名法为3,3,5,5-四甲基庚烷;
系统命名法为3,3,5,5-四甲基庚烷;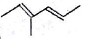 表示的有机物的结构简式是CH3CH=C(CH3)CH=CHCH3;
表示的有机物的结构简式是CH3CH=C(CH3)CH=CHCH3;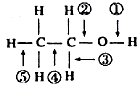
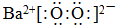 .
.
 ,反应类型为酯化反应.
,反应类型为酯化反应.