题目内容
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生反应NO2+SO2?Ο3+NO,平衡时NO2与SO2体积比为1:6,则平衡常数K= ;多余的NO与空气(设空气中氧气和氮气体积比为1:4)按一定比例通入水中即可完全吸收,VNO:V空气= .NO可以与活性炭发生如下反应C(s)+2NO(g)?N2(g)+CO2(g),若温度恒定,提供足量的活性炭,增大NO的浓度,NO的转化率 (选填“增大”、“减小”、“不变”或“无法确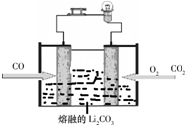 定”).
定”).
(2)CO可以组成燃料电池,用以提供电能,根据右图所示写出正极反应式: .
(1)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生反应NO2+SO2?Ο3+NO,平衡时NO2与SO2体积比为1:6,则平衡常数K=
 定”).
定”).(2)CO可以组成燃料电池,用以提供电能,根据右图所示写出正极反应式:
考点:原电池和电解池的工作原理,化学平衡常数的含义
专题:
分析:(1)根据三段式以及化学平衡常数表达式计算化学平衡常数,NO与氧气和水生成硝酸的反应方程式进行计算体积比,根据影响平衡移动因素判断;
(2)根据原电池原理书写电极反应.
(2)根据原电池原理书写电极反应.
解答:
解:(1)利用三段式进行计算,
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
则
=
,故x=
a,故平衡常数为K=
=
≈2.67,
根据反应4NO+3O2+2H2O=4HNO3,可知,NO与空气按一定比例通入水中被完全吸收,则VNO:VO2=4:3,而空气中氧气和氮气体积比为1:4,所以VNO:V空气=4:15,对于反应C(s)+2NO(g)?N2(g)+CO2(g),反应前后气体体积不变,压强对平衡移动没有影响,若温度恒定,提供足量的活性炭,增大NO的浓度,反应正向移动,各物质的浓度会成比例增大,相当于物质的量不变时,压缩体积,所以NO的转化率不变,
故答案为:2.67或
;4:15;不变;
(2)根据原电池原理可知,在CO燃料电池中,CO是还原剂,在负极发生氧化反应,O2是氧化剂,在正极发生还原反应,碳酸锂做电解质,所以正极的电极反应式为2CO2+O2+4e-═2CO32-,
故答案为:2CO2+O2+4e-═2CO32-.
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
则
| 1-x |
| 2a-x |
| 1 |
| 6 |
| 4 |
| 5 |
| x?x |
| (a-x)?(2a-x) |
| 8 |
| 3 |
根据反应4NO+3O2+2H2O=4HNO3,可知,NO与空气按一定比例通入水中被完全吸收,则VNO:VO2=4:3,而空气中氧气和氮气体积比为1:4,所以VNO:V空气=4:15,对于反应C(s)+2NO(g)?N2(g)+CO2(g),反应前后气体体积不变,压强对平衡移动没有影响,若温度恒定,提供足量的活性炭,增大NO的浓度,反应正向移动,各物质的浓度会成比例增大,相当于物质的量不变时,压缩体积,所以NO的转化率不变,
故答案为:2.67或
| 8 |
| 3 |
(2)根据原电池原理可知,在CO燃料电池中,CO是还原剂,在负极发生氧化反应,O2是氧化剂,在正极发生还原反应,碳酸锂做电解质,所以正极的电极反应式为2CO2+O2+4e-═2CO32-,
故答案为:2CO2+O2+4e-═2CO32-.
点评:本题将电化学、化学平衡、化学方程式的计算等知识柔和在一起进行考查,有一定的综合性,但难度不大,答题时注意基础知识的灵活运用.

练习册系列答案
相关题目
某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和天然气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体;⑧合金的熔点比它的各成分的熔点高、合金的硬度和强度一般比纯金属低⑨Na2O2与CO2反应,Na2O2是氧化剂、CO2是还原剂.上述说法正确的是( )
| A、①③④⑧ | B、①②⑥⑨ |
| C、③⑤⑥⑦ | D、①③④⑦ |
 在某恒容密闭容器中通入一定量的二氧化氮,发生反应:2NO2(g)?N2O4(g),测定体系中x随着反应温度(T)变化的关系如图所示,下列关于x说法正确的是( )
在某恒容密闭容器中通入一定量的二氧化氮,发生反应:2NO2(g)?N2O4(g),测定体系中x随着反应温度(T)变化的关系如图所示,下列关于x说法正确的是( )| A、表示二氧化氮的转化率 |
| B、表示二氧化氮的体积分数 |
| C、表示该反应的平衡常数 |
| D、表示该密闭容器混合气体的密度 |

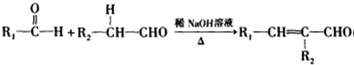 (R1、R2为烃基或氢原子);
(R1、R2为烃基或氢原子); (R1、R2为烃基)
(R1、R2为烃基) )是有机工业的重要原料,可用于合成多种有机物.
)是有机工业的重要原料,可用于合成多种有机物.
 ,合成路线流程图为:
,合成路线流程图为: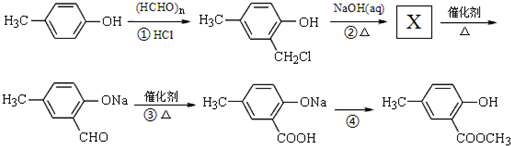
 的合成路线流程图表示(有机物用结构简式,注明反应试剂和条件)
的合成路线流程图表示(有机物用结构简式,注明反应试剂和条件)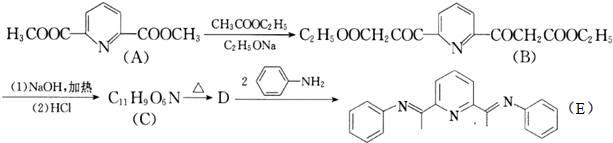
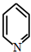 )且环上只有2个取代基;
)且环上只有2个取代基;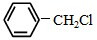 和
和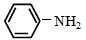 为原料合成西佛碱N-苯基苯甲亚胺(
为原料合成西佛碱N-苯基苯甲亚胺(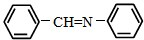 ),请你拟出合成路线:
),请你拟出合成路线:
 是一种合成药物的中间体,请写出以CH2(COOH)2、CH2Cl2 及
是一种合成药物的中间体,请写出以CH2(COOH)2、CH2Cl2 及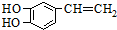 为原料制备该化合物,合成该化合物路线流程图(无机试剂任用),
为原料制备该化合物,合成该化合物路线流程图(无机试剂任用),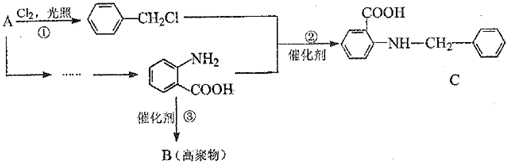
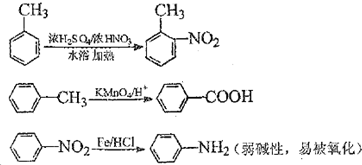
 中官能团的名称
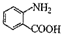
中官能团的名称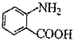 分子与一个α-氨基丙酸分子反应能生成的有机物的结构简式是
分子与一个α-氨基丙酸分子反应能生成的有机物的结构简式是 的同分异构体的结构简式
的同分异构体的结构简式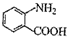 的合成路线.(提示:①合成过程中无机试剂任选;②合成路线表示方法示例如图:C2H5OH
的合成路线.(提示:①合成过程中无机试剂任选;②合成路线表示方法示例如图:C2H5OH )
)