题目内容
一包氯化镁和硫酸钠组成的混合物中,为测定其中氯化镁的质量分数,小亮同学称取该混合物样品20g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液100g,平均分四次加入其中,充分振荡后,测得实验数据如下表所示,请分析并进行相关的计算:
(1)上表中X的数值是 ;
(2)试求原固体混合物样品中氯化镁的质量分数是 .
| 次数 | 1 | 2 | 3 | 4 |
| 加入氢氧化钠溶液的质量(g) | 25 | 25 | 25 | 25 |
| 生成沉淀的质量(g) | 2.9 | X | 8.7 | 8.7 |
(2)试求原固体混合物样品中氯化镁的质量分数是
考点:化学方程式的有关计算,有关混合物反应的计算
专题:实验探究和数据处理题
分析:(1)根据表中数据知,第3次和第4次加入NaOH溶液时沉淀的质量不变,说明镁离子完全被沉淀,则第2次加入NaOH溶液使镁离子没有完全被沉淀,则第1、2次加入相同量的NaOH溶液产生氢氧化镁质量相等;
(2)发生的离子反应方程式为Mg2++2OH-=Mg(OH)2↓,8.7gMg(OH)2的物质的量=
=0.15mol,根据Mg原子守恒得n(MgCl2)=n[Mg(OH)2]=0.15mol,m(MgCl2)=95g/mol×0.15mol=14.25g,据此计算质量分数.
(2)发生的离子反应方程式为Mg2++2OH-=Mg(OH)2↓,8.7gMg(OH)2的物质的量=
| 8.7g |
| 58g/mol |
解答:
解:(1)根据表中数据知,第3次和第4次加入NaOH溶液时沉淀的质量不变,说明镁离子完全被沉淀,则第2次加入NaOH溶液使镁离子没有完全被沉淀,则第1、2次加入相同量的NaOH溶液产生氢氧化镁质量相等为2.9g,所以X=2.9+2.9=5.8,
故答案为:5.8;
(2)发生的离子反应方程式为Mg2++2OH-=Mg(OH)2↓,8.7gMg(OH)2的物质的量=
=0.15mol,根据Mg原子守恒得n(MgCl2)=n[Mg(OH)2]=0.15mol,m(MgCl2)=95g/mol×0.15mol=14.25g,则氯化镁质量分数=
×100%=71.25%,故答案为:71.25%.
故答案为:5.8;
(2)发生的离子反应方程式为Mg2++2OH-=Mg(OH)2↓,8.7gMg(OH)2的物质的量=
| 8.7g |
| 58g/mol |
| 14.25g |
| 20g |
点评:本题考查物质含量的测定,侧重考查分析、计算能力,正确判断第2次生成沉淀的质量是解本题关键,利用原子守恒进行计算,题目难度不大.

练习册系列答案
相关题目
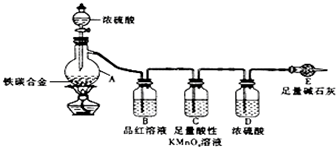
 定”).
定”).
 -OH和
-OH和 CH2OHE.NH2CH2COOH与NH2CH(CH3)COOHF.CH3CHO与CH2=CHCHO.
CH2OHE.NH2CH2COOH与NH2CH(CH3)COOHF.CH3CHO与CH2=CHCHO.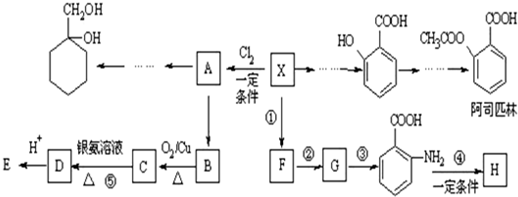
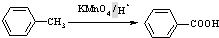
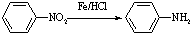 (苯胺,易被氧化)
(苯胺,易被氧化)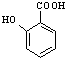 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有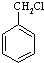 和其他无机物合成
和其他无机物合成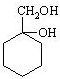 最合理的方案(不超过4步),请在答题纸的方框中表示.例:
最合理的方案(不超过4步),请在答题纸的方框中表示.例: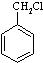
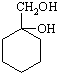
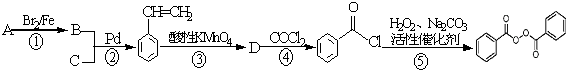
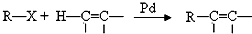
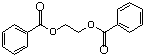 的流程,无机物任选,注明反应条件.
的流程,无机物任选,注明反应条件.