题目内容
 在某恒容密闭容器中通入一定量的二氧化氮,发生反应:2NO2(g)?N2O4(g),测定体系中x随着反应温度(T)变化的关系如图所示,下列关于x说法正确的是( )
在某恒容密闭容器中通入一定量的二氧化氮,发生反应:2NO2(g)?N2O4(g),测定体系中x随着反应温度(T)变化的关系如图所示,下列关于x说法正确的是( )| A、表示二氧化氮的转化率 |
| B、表示二氧化氮的体积分数 |
| C、表示该反应的平衡常数 |
| D、表示该密闭容器混合气体的密度 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:2NO2(g)?N2O4(g)为放热反应,升高温度,平衡逆向移动,题中图象曲线变化先减小后增大,减小部分没有达到平衡,增大说明升高温度,x增大,以此解答该题.
解答:
解:2NO2(g)?N2O4(g)为放热反应,
A.升高温度,平衡逆向移动,二氧化氮的转化率减小,与曲线不符,故A错误;
B.升高温度,平衡逆向移动,二氧化氮的体积分数增大,与曲线相符,故B正确;
C.正反应放热,升高温度,平衡逆向移动,该反应的平衡常数减小,故C错误;
D.气体质量不变,容器体积不变,则密度不变,故D错误.
故选B.
A.升高温度,平衡逆向移动,二氧化氮的转化率减小,与曲线不符,故A错误;
B.升高温度,平衡逆向移动,二氧化氮的体积分数增大,与曲线相符,故B正确;
C.正反应放热,升高温度,平衡逆向移动,该反应的平衡常数减小,故C错误;
D.气体质量不变,容器体积不变,则密度不变,故D错误.
故选B.
点评:本题考查化学平衡的移动以及影响因素,为高考常见题型,侧重学生的分析能力的考查,主要把握图象曲线的变化特点,结合反应的特征解答,难度不大.

练习册系列答案
相关题目
 某学生欲用已知物质的量浓度为0.1000mol/L的NaOH溶液来测定未知物质的量浓度的盐酸,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度为0.1000mol/L的NaOH溶液来测定未知物质的量浓度的盐酸,选择酚酞作指示剂.请填写下列空白: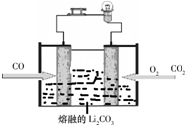 定”).
定”).
 -OH和
-OH和 CH2OHE.NH2CH2COOH与NH2CH(CH3)COOHF.CH3CHO与CH2=CHCHO.
CH2OHE.NH2CH2COOH与NH2CH(CH3)COOHF.CH3CHO与CH2=CHCHO.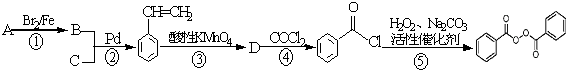
 的流程,无机物任选,注明反应条件.
的流程,无机物任选,注明反应条件.