题目内容
有机物A (  )是有机工业的重要原料,可用于合成多种有机物.
)是有机工业的重要原料,可用于合成多种有机物.
I.由A为原料,可以合成有机物D.根据如下流程回答:
已知:
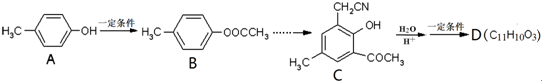
(1)A的名称为 ;
(2)D的结构简式为 .
Ⅱ.以A为主要原料合成有机物G: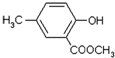 ,合成路线流程图为:
,合成路线流程图为:
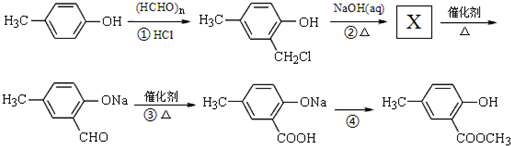
(3)反应②的化学方程式 ;
(4)写出检验反应③的产物中残留有机反应物的试剂 ;
(5)写出符合下列条件的G的同分异构体的其中一种结构简式:
①分子中含有苯环,且苯环上一氯代物只有一种;②能发生水解反应; ③遇FeCl3溶液显紫色.
(6)根据已有知识并结合相关信息,写出以A的最简单同系物为原料制备 的合成路线流程图表示(有机物用结构简式,注明反应试剂和条件)
的合成路线流程图表示(有机物用结构简式,注明反应试剂和条件)
(合成路线常用的表示方式为:A
B…
目标产物)
 )是有机工业的重要原料,可用于合成多种有机物.
)是有机工业的重要原料,可用于合成多种有机物.I.由A为原料,可以合成有机物D.根据如下流程回答:
已知:


(1)A的名称为
(2)D的结构简式为
Ⅱ.以A为主要原料合成有机物G:
 ,合成路线流程图为:
,合成路线流程图为:
(3)反应②的化学方程式
(4)写出检验反应③的产物中残留有机反应物的试剂
(5)写出符合下列条件的G的同分异构体的其中一种结构简式:
①分子中含有苯环,且苯环上一氯代物只有一种;②能发生水解反应; ③遇FeCl3溶液显紫色.
(6)根据已有知识并结合相关信息,写出以A的最简单同系物为原料制备
 的合成路线流程图表示(有机物用结构简式,注明反应试剂和条件)
的合成路线流程图表示(有机物用结构简式,注明反应试剂和条件)(合成路线常用的表示方式为:A
| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
考点:有机物的合成
专题:有机物的化学性质及推断
分析:Ⅰ.A为对甲基苯酚,C在酸性条件下发生水解反应,-CN转化为-COOH生成 ,一定条件下由得到D,结合D的分子式可知,
,一定条件下由得到D,结合D的分子式可知, 脱去1分子水生成D,故羧基与酚羟基发生酯化反应;
脱去1分子水生成D,故羧基与酚羟基发生酯化反应;
Ⅱ.(3)反应②发生卤代烃的水解反应、酚羟基与氢氧化钠的反应,生成X为 ;
;
(4)检验反应③的产物中残留有机反应物,可以检验是否含有醛基;
(5)G的同分异构体满足:①分子中含有苯环,②能发生水解反应,含有酯基,③遇FeCl3溶液显紫色,含有酚羟基,且苯环上一氯代物只有一种,结合G的结构可知,还含有2个甲基、1个-OOCH,且-OH与-OOCH处于对位位置,2个甲基分别与-OH相邻或与-OOCH相邻;
(6)A最简单的同系物为苯酚,结合转化中第①步反应可以得到 ,再与氢气发生加成反应得到
,再与氢气发生加成反应得到 ,然后发生水解反应得到
,然后发生水解反应得到 ,最后发生消去反应得到
,最后发生消去反应得到 .
.
 ,一定条件下由得到D,结合D的分子式可知,
,一定条件下由得到D,结合D的分子式可知, 脱去1分子水生成D,故羧基与酚羟基发生酯化反应;
脱去1分子水生成D,故羧基与酚羟基发生酯化反应;Ⅱ.(3)反应②发生卤代烃的水解反应、酚羟基与氢氧化钠的反应,生成X为
 ;
;(4)检验反应③的产物中残留有机反应物,可以检验是否含有醛基;
(5)G的同分异构体满足:①分子中含有苯环,②能发生水解反应,含有酯基,③遇FeCl3溶液显紫色,含有酚羟基,且苯环上一氯代物只有一种,结合G的结构可知,还含有2个甲基、1个-OOCH,且-OH与-OOCH处于对位位置,2个甲基分别与-OH相邻或与-OOCH相邻;
(6)A最简单的同系物为苯酚,结合转化中第①步反应可以得到
 ,再与氢气发生加成反应得到
,再与氢气发生加成反应得到 ,然后发生水解反应得到
,然后发生水解反应得到 ,最后发生消去反应得到
,最后发生消去反应得到 .
.解答:
解:Ⅰ.(1)根据A的结构可知,其名称为对甲基苯酚,故答案为:对甲基苯酚;
(2)C在酸性条件下发生水解反应,-CN转化为-COOH生成 ,一定条件下由得到D,结合D的分子式可知,
,一定条件下由得到D,结合D的分子式可知, 脱去1分子水生成D,羧基与酚羟基发生酯化反应,故D的结构简式为
脱去1分子水生成D,羧基与酚羟基发生酯化反应,故D的结构简式为 ,故答案为:
,故答案为: ;
;
Ⅱ.(3)反应②发生卤代烃的水解反应、酚羟基与氢氧化钠的反应,生成X为 ,反应方程式为:
,反应方程式为: ,
,
故答案为: ;
;
(4)检验反应③的产物中残留有机反应物,可以检验是否含有醛基,所用试剂为银氨溶液或新制氢氧化铜悬浊液,故答案为:银氨溶液或新制氢氧化铜悬浊液;
(5)G的同分异构体满足:①分子中含有苯环,②能发生水解反应,含有酯基,③遇FeCl3溶液显紫色,含有酚羟基,且苯环上一氯代物只有一种,结合G的结构可知,还含有2个甲基、1个-OOCH,且-OH与-OOCH处于对位位置,2个甲基分别与-OH相邻或与-OOCH相邻,符合条件的同分异构体为: ,故答案为:
,故答案为: 任意一种;
任意一种;
(6)A最简单的同系物为苯酚,结合转化中第①步反应可以得到 ,再与氢气发生加成反应得到
,再与氢气发生加成反应得到 ,然后发生水解反应得到
,然后发生水解反应得到 ,最后发生消去反应得到
,最后发生消去反应得到 ,合成路线流程图为:
,合成路线流程图为: ,
,
故答案为: .
.
(2)C在酸性条件下发生水解反应,-CN转化为-COOH生成
 ,一定条件下由得到D,结合D的分子式可知,
,一定条件下由得到D,结合D的分子式可知, 脱去1分子水生成D,羧基与酚羟基发生酯化反应,故D的结构简式为
脱去1分子水生成D,羧基与酚羟基发生酯化反应,故D的结构简式为 ,故答案为:
,故答案为: ;
;Ⅱ.(3)反应②发生卤代烃的水解反应、酚羟基与氢氧化钠的反应,生成X为
 ,反应方程式为:
,反应方程式为: ,
,故答案为:
 ;
;(4)检验反应③的产物中残留有机反应物,可以检验是否含有醛基,所用试剂为银氨溶液或新制氢氧化铜悬浊液,故答案为:银氨溶液或新制氢氧化铜悬浊液;
(5)G的同分异构体满足:①分子中含有苯环,②能发生水解反应,含有酯基,③遇FeCl3溶液显紫色,含有酚羟基,且苯环上一氯代物只有一种,结合G的结构可知,还含有2个甲基、1个-OOCH,且-OH与-OOCH处于对位位置,2个甲基分别与-OH相邻或与-OOCH相邻,符合条件的同分异构体为:
 ,故答案为:
,故答案为: 任意一种;
任意一种;(6)A最简单的同系物为苯酚,结合转化中第①步反应可以得到
 ,再与氢气发生加成反应得到
,再与氢气发生加成反应得到 ,然后发生水解反应得到
,然后发生水解反应得到 ,最后发生消去反应得到
,最后发生消去反应得到 ,合成路线流程图为:
,合成路线流程图为: ,
,故答案为:
 .
.
点评:本题考查有机物的推断与合成、官能团的结构与性质、同分异构体书写等,(6)中合成路线设计关键是利用转化关系中隐含的增长碳链信息,需要学生熟练掌握官能团的性质与转化,难度中等.

练习册系列答案
相关题目
下列电离或水解方程式中,正确的是( )
| A、CH3COOH=CH3COO-+H+ |
| B、Br-+H2O?HBr+OH- |
| C、CO32-+2H2O?H2CO3+2OH- |
| D、NH4++H2O?NH3?H2O+H+ |
用标准的盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
| A、用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 |
| B、用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定 |
| C、用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定 |
| D、用酚酞作指示剂滴至红色刚变无色时即停止加盐酸 |
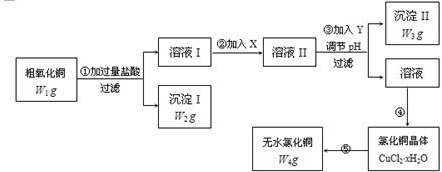
 某学生欲用已知物质的量浓度为0.1000mol/L的NaOH溶液来测定未知物质的量浓度的盐酸,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度为0.1000mol/L的NaOH溶液来测定未知物质的量浓度的盐酸,选择酚酞作指示剂.请填写下列空白:

 定”).
定”).