题目内容
16.无水AlCl3易升华,可用作有机合成的催化剂等.工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下.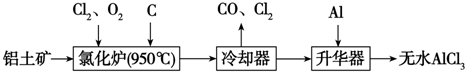
(1)为促进反应的进行,实际生产中需加入焦炭,其原因是加入焦炭消耗反应生成的氧气,使平衡向正反应方向移动.
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为SO32-+C12+H2O═SO42-+2C1-+2H+.
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是除去FeCl3.
分析 根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉的产物中含有A1C13,冷凝器尾气含有CO,所以Al2O3、C12和C反应,生成A1C13和CO,A1C13为共价化合物,升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较高,升华制备无水AlCl3,加入少量Al目的是除去FeCl3,以此解答该题.
解答 解:根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉的产物中含有A1C13,冷凝器尾气含有CO,所以Al2O3、C12和C反应,生成A1C13和CO,A1C13为共价化合物,升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较高,升华制备无水AlCl3,加入少量Al目的是除去FeCl3,
(1)在一定条件下氧化铝与氯气反应生成氯化铝和氧气,加入焦炭,氧气和碳反应生成CO而消耗氧气,有利于平衡正向移动,
故答案为:加入焦炭消耗反应生成的氧气,使平衡向正反应方向移动;
(2)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-.反应离子方程式为SO32-+C12+H2O═SO42-+2C1-+2H+,
故答案为:SO32-+C12+H2O═SO42-+2C1-+2H+;
(3)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除FeCl3去.所以加入少量Al目的是除去FeCl3,
故答案为:除去FeCl3.
点评 本题考查学生对于工艺流程原理的理解、对操作与实验条件控制的理解等,涉及常用化学用语书写、分离提纯等,需要学生具备扎实的基础与综合运用能力,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.设NA表示阿伏加德罗常数,下列叙述中,正确的是( )
| A. | 25℃、101kPa时,11.2L H2中含有的原子数为NA | |
| B. | 78g Na2O2与足量水充分反应时电子转移数为2NA | |
| C. | 等质量的CO与CO2中所含碳原子数之比为11:7 | |
| D. | 将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L |
7.关于溶液、胶体和浊液三种分散系,下列叙述中不正确的是( )
| A. | 丁达尔现象可用来区分AgI胶体和FeCl3溶液 | |
| B. | 静置片刻后,Fe(OH)3胶体中会出现分层现象 | |
| C. | 溶液、胶体、浊液的根本区别是分散质粒子直径的大小 | |
| D. | 胶体的主要性质有:丁达尔现象、电泳、聚沉等 |
4.下列化学方程式错误的是( )
| A. | Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+H2O+CO2↑ | B. | MgCO3+CO2+H2O═Mg(HCO3)2 | ||
| C. | MgCO3+H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑ | D. | CaCO3+H2O═Ca(OH)2+CO2↑ |
11.在溶液中可以共存,加OH-产生沉淀,加H+生成气体的一组离子是( )
| A. | Na+、Cu2+、Cl-、CO32- | B. | HCO3-、Cl-、Fe3+、Na+ | ||
| C. | Cl-、K+、NO3-、Fe2+、 | D. | S2-、SO42-、NH4+、Fe2+ |
1.25℃时,下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.lmol•L-lNaHC2O4溶液(pH=5.5):c(Na+)>c( HC2O4-)>c(H2C2O4)>c(C2O42- ) | |
| B. | 0.lmol•L-1NaHS 溶液:C(OH-)+c(S2-)=c( H+)+c(H2S) | |
| C. | 0.lmol•L-1CH3COOH 溶液和 0.lmol•L-1CH3COONa 溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c( OH-) | |
| D. | 0.lmol•L-lNH4HSO4 溶液中滴加 0.lmol•L-1NaOH 溶液至中性:c(Na+ )>c(SO42- )>c(NH4+ )>c(OH-)=c(H+) |
8.下列关于乙醇在各种反应中断裂键的说法不正确的是( )
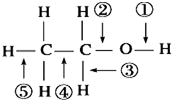

| A. | 乙醇与钠反应,键①断裂 | |
| B. | 乙醇在Ag催化作用下与O2反应,键①③断裂 | |
| C. | 乙醇完全燃烧时,只有①②键断裂 | |
| D. | 乙醇与氢卤酸反应,键②断裂 |
5.下列说法不正确的是( )
| A. | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,金属铝的熔点较低 | |
| B. | 铝与Fe2O3发生铝热反应后固体的质量不变 | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | Al、HCl、NaOH中任意两种物质在一定条件下均能发生反应 |
12.下列各分子中所有原子都满足最外层为8电子结构的是( )
| A. | BeCl2 | B. | BF3 | C. | PCl5 | D. | CCl4 |