题目内容
1.25℃时,下列溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.lmol•L-lNaHC2O4溶液(pH=5.5):c(Na+)>c( HC2O4-)>c(H2C2O4)>c(C2O42- ) | |
| B. | 0.lmol•L-1NaHS 溶液:C(OH-)+c(S2-)=c( H+)+c(H2S) | |
| C. | 0.lmol•L-1CH3COOH 溶液和 0.lmol•L-1CH3COONa 溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c( OH-) | |
| D. | 0.lmol•L-lNH4HSO4 溶液中滴加 0.lmol•L-1NaOH 溶液至中性:c(Na+ )>c(SO42- )>c(NH4+ )>c(OH-)=c(H+) |
分析 A.0.lmol•L-lNaHC2O4溶液(pH=5.5)溶液中HC2O4-电离大于水解:
B.0.lmol•L-1NaHS 溶液中电荷守恒和物料守恒计算,分析判断选项;
C.0.lmol•L-1CH3COOH 溶液和 0.lmol•L-1CH3COONa 溶液等体积混合,醋酸电离大于醋酸根离子水解,溶液显酸性;
D.向 NH4HSO4中滴加NaOH溶液,当二者物质的量相同时,溶质为等物质的量的(NH4)2SO4和Na2SO4,溶液呈酸性,再滴加少许NaOH呈中性.
解答 解:A.0.lmol•L-lNaHC2O4溶液(pH=5.5)溶液中HC2O4-电离大于水解,c(Na+)>c( HC2O4-)>c(C2O42- )>c(H2C2O4),故A错误;
B.0.lmol•L-1NaHS 溶液中电荷守恒c(H+)+c(Na+)=c(OH-)+c(HS-)+2c(S2-),物料守恒,c(Na+)=c(H2S)+c(HS-)+c(S2-),代入计算得到:C(OH-)+c(S2-)=c( H+)+c(H2S),故B正确;
C..0.lmol•L-1CH3COOH 溶液和 0.lmol•L-1CH3COONa 溶液等体积混合,醋酸电离大于醋酸根离子水解,溶液显酸性:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c( OH-),故C错误;
D.NH4HSO4中滴加NaOH溶液,若二者物质的量相同时,溶质为等物质的量的(NH4)2SO 4和Na2SO 4,溶液呈酸性,需要再滴加少许NaOH呈中性,c(Na+)+c(NH4+)=2c(SO42-),故溶液中离子浓度大小关系为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故D正确;
故选BD.
点评 本题考查了电解质溶液中离子浓度大小比较、盐类水解原理、电解质溶液中电荷守恒、物料守恒等知识点,掌握基础是解题关键,题目难度中等.


已知各离子沉淀的范围如下表
| 离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀pH | 1,9 | 7.0 | 6,7 |
| 沉淀完全pH | $\frac{3}{4}$ | 9.0 | 10.0 |
(1)将冰铜矿粉碎的目的是提高浸出率,另外一种提高浸出率的措施是升高温度或者增大浸取剂浓度等.
(2)溶液1的成分是NaAlO2、Na2SiO3、NaOH,若向其中通入足量的CO2可以析出的沉淀是H2SiO3、Al(OH)3,
此时溶液中的溶质将变成NaHCO3.
(3)沉淀1加入H2O2和稀H2SO4后,溶液中阴离子只有SO42-,金属阳离子有Cu2+ 和F3+,则该过程的离子方程式为:2H++Cu2S+5H2O2═2Cu2++SO42-+6H2O,2H++2FeS+9H2O2═2Fe3++2SO42-+10H2O.
(4)溶液2调节的pH范围为3.4≤pH<6.7.
(5>对红褐色沉淀进行洗涤并干燥处理,可以得到纯净的Fe(OH)3,可用于制备红色颜料Fe2O3.检验红褐色沉淀是否洗净的方法是取最后一次洗涤液于试管中,滴加BaCl2溶液,若不产生白色沉淀,则沉淀已经洗净.
(6)用惰性电极对溶液3进行电解,电解CuSO4溶液的化学方程式为:2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;
当两极共产生标准状况下44.8L气体且阴阳两极产生的气体体积之比为1:1时,则析出的铜的质量为64g.
| A. | 4个--CH3,能生成4种一氯代物 | B. | 3个--CH3,能生成4种一氯代物 | ||
| C. | 3个--CH3,能生成5种一氯代物 | D. | 2个--CH3,能生成4种一氯代物 |
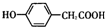 ;写出A与NaHCO3溶液反应的化学方程式
;写出A与NaHCO3溶液反应的化学方程式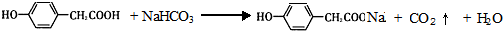 .
.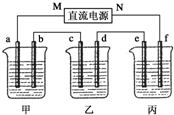 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.

 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.