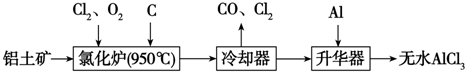
题目内容
6.设NA表示阿伏加德罗常数,下列叙述中,正确的是( )| A. | 25℃、101kPa时,11.2L H2中含有的原子数为NA | |
| B. | 78g Na2O2与足量水充分反应时电子转移数为2NA | |
| C. | 等质量的CO与CO2中所含碳原子数之比为11:7 | |
| D. | 将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L |
分析 A、25℃、101kPa时,气体摩尔体积大于22.4L/mol;
B、求出过氧化钠的物质的量,然后根据1mol过氧化钠和水反应转移1mol电子来分析;
C、当质量相同时,物质的量之比与摩尔质量成反比;
D、将硫酸溶于500mL水中,溶液体积大于500mL.
解答 解:A、25℃、101kPa时,气体摩尔体积大于22.4L/mol,故11.2L氢气的物质的量小于0.5mol,则含有的H原子个数小于NA个,故A错误;
B、78g过氧化钠的物质的量为1mol,而1mol过氧化钠和水的反应为歧化反应,1mol过氧化钠反应转移1mol电子,即转移NA个,故B错误;
C、当质量相同时,物质的量之比与摩尔质量成反比,故等质量的CO和二氧化碳的物质的量之比为44:28=11:7,则含有的碳原子个数为11:7,故C正确;
D、将硫酸溶于500mL水中,溶液体积大于500mL,故所得溶液中的硫酸的浓度小于2mol/L,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
15.检验牙膏中是否含有甘油选用的试剂是( )
| A. | 氢氧化钠溶液 | B. | 氢氧化铜浊液 | C. | 醋酸溶液 | D. | 碳酸钠溶液 |

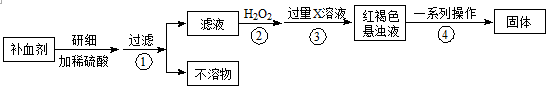
 如图为氨气溶于水的喷泉实验装置(图中固定装置均已略去).
如图为氨气溶于水的喷泉实验装置(图中固定装置均已略去).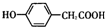 ;写出A与NaHCO3溶液反应的化学方程式
;写出A与NaHCO3溶液反应的化学方程式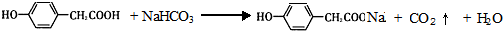 .
. $→_{FeCl_{3}}^{Cl_{2}}$分离得A$→_{过氧化苯甲酰}^{NBS}$
$→_{FeCl_{3}}^{Cl_{2}}$分离得A$→_{过氧化苯甲酰}^{NBS}$ $\stackrel{NaCN}{→}$B$→_{50%NaOH}^{CH_{3}CHClCH_{3}}$
$\stackrel{NaCN}{→}$B$→_{50%NaOH}^{CH_{3}CHClCH_{3}}$ $→_{②SOCl_{2}}^{①H+}$C
$→_{②SOCl_{2}}^{①H+}$C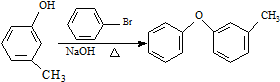 $→_{Co(OAc)_{2}}^{O_{2}}$
$→_{Co(OAc)_{2}}^{O_{2}}$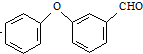 $→_{H+}^{NaCN}$D
$→_{H+}^{NaCN}$D +HCl
+HCl 中的官能团有醚键和醛基(填名称).
中的官能团有醚键和醛基(填名称).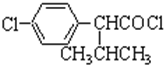 ;合成3中的有机反应类型为取代反应.
;合成3中的有机反应类型为取代反应. .
. )合成一种抗早产药的重要中间体.根据已有知识并结合相关信息,写出以CH3Br和
)合成一种抗早产药的重要中间体.根据已有知识并结合相关信息,写出以CH3Br和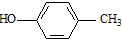 为有机原料(无机试剂和反应条件任选)合成E的路线流程图.合成路线流程图示例如下:CH2═CH2$→_{催化剂}^{O_{2}}$CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH.
为有机原料(无机试剂和反应条件任选)合成E的路线流程图.合成路线流程图示例如下:CH2═CH2$→_{催化剂}^{O_{2}}$CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH.