题目内容
5.在恒温条件下,有甲、乙两容器,甲容器为体积不变的密闭容器,乙容器为一个带有理想活塞(即无质量、无摩擦力的刚性活塞)的体积可变的密闭容器,两容器起始状态完全相同,都充有C气体,若发生可逆反应C(g)?A(g)+B(g),经一段时间后,甲、乙两容器反应都达到平衡.下列说法中正确的是( )| A. | 反应速率:乙>甲 | B. | 平衡时C的体积分数:乙>甲 | ||
| C. | 平衡时C的转化率:乙>甲 | D. | 平衡时A的物质的量:甲>乙 |
分析 甲为恒容,乙为恒压,随着反应的进行,甲容器压强逐渐增大,而增大压强,平衡向逆方向移动,而乙容器中压强不变,甲与乙容器相比,甲中反应速率较大、平衡向着逆向移动,据此进行解答.
解答 解:甲为恒容,乙为恒压,随着反应的进行,甲容器压强逐渐增大,而乙压强不变,
A.甲中压强较大,由于压强越大反应速率越大,则反应速率:甲>乙,故A错误;
B.增大压强平衡向逆方向移动,甲中压强较大,则平衡时C的体积分数:甲>乙,故B错误;
C.增大压强平衡向逆方向移动,C的转化率减小,则平衡时C的转化率:乙>甲,故C正确;
D.增大压强平衡向逆方向移动,则平衡时A的物质的量:乙>甲,故D错误;
故选C.
点评 本题考查化学平衡及其影响因素,题目难度不大,本题注意从压强对平衡移动的影响的角度比较甲乙两个状态,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
6.有关如图装置的叙述中,正确的是( )
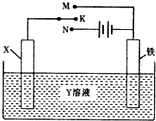

| A. | 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为外接电源的阴极保护法 | |
| B. | 若X为碳棒,Y为饱和NaOH溶液,开关K置于N处,保持温度不变,则溶液的pH保持不变 | |
| C. | 若X为银棒,Y为硝酸银溶液,开关K置于N处,铁棒质量将增加,溶液中银离子浓度将减小 | |
| D. | 若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铁电极移动 |
7.在标准状况下,与48g氧气所含的原子数目相同的是( )
| A. | 8g CH4 | B. | 22.4L H2O | C. | 17g NH3 | D. | 67.2L He |
20.下列各对物质,相互间不属于同系物的是( )
| A. | CH3-CH═CH2与C2H4 | B. | CH3COOCH3与CH3CH2COOCH3 | ||
| C. | 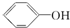 与 与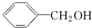 | D. | CH3CH2Cl与CH3CHClCH3 |
17.构成下列四种物质的微粒间,既存在离子键又存在共价键的是( )
| A. | CH3CH2ONa | B. | K2S | C. | MgCl2 | D. | SO3 |
14.某温度下,BaSO4与水组成的混合物中,存在如下过程:BaSO4(s)?Ba2+(aq)+SO42-(aq),向其中加入少量Na2SO4固体,下列说法错误的是( )
| A. | BaSO4溶解的量减小 | B. | BaSO4的电离程度减小 | ||
| C. | 溶液的导电能力增大 | D. | c (Ba2+)与c (SO42-)的乘积增大 |
15.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相同时,反应中消耗的HCl和NaOH的物质的量之比为( )
| A. | 3:1 | B. | 1:1 | C. | 2:1 | D. | 1:3 |
 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示.反应在t时刻达到平衡,据图回答下列问题:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示.反应在t时刻达到平衡,据图回答下列问题: