题目内容
13.在航天航空工业上银铜合金有许多用途.以废旧航天器为原料回收银并制备含铜化工产品的工艺流程如图所示.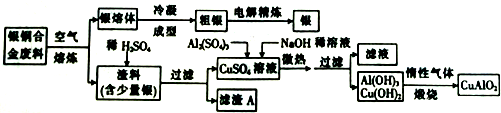
回答下列问题:
(1)银铜合金在空气中熔炼的氧化产物是CuO(填化学式,下同).
(2)滤渣A的主要成分是Ag;等物质的量的Al(OH)3与Cu(OH)2在惰性气体中煅烧时,除了生成
CuAlO2外,还会生成H2O和O2.
(3)向CuSO3溶液中加入Al2(SO4)3和NaOH稀溶液,其中NaOH稀溶液的作用是使铝离子和铜离子沉淀完全.
(4)电解法精炼银中所用的电解质溶液应为AgNO3溶液,阳极材料是粗银.
(5)若产品CuAlO2能溶于浓硝酸,则反应的化学方程式为CuAlO2+6HNO3(浓)=Cu(NO3)2+Al(NO3)3+NO2↑+3H2O.若有1 mol CuAlO2参与反应,生成气体的体积(标准状况下)小于22.4L,其原因可能是二氧化氮转化为四氧化二氮、生成了一氧化氮(写两条,不考虑与水的反应).
分析 由工艺流程图可知,废料在空气中熔炼时,Cu被氧化,滤渣中含有CuO及少量Ag,向滤渣中加入硫酸进行酸浸,CuO与硫酸反应,过滤得到硫酸铜溶液(含有硫酸),滤渣A为Ag;向滤液中加入硫酸铝、氢氧化钠,得到氢氧化铝、氢氧化铜,灼烧中会得到CuO、Al2O3,二者反应得到CuAlO2,银熔体冷却成型得到粗银,通过电解精炼得到银,
(1)废料在空气中熔炼时,Cu被氧化,滤渣中含有CuO及少量Ag,元素化合价升高的被氧化得到氧化产物;
(2)向滤渣中加入硫酸进行酸浸,CuO与硫酸反应,过滤得到硫酸铜溶液(含有硫酸),滤渣A为Ag;由上述分析可知,CuO、Al2O3反应得到CuAlO2,由电荷守恒可知,O元素化合价升高,有氧气生成;
(3)向CuSO4溶液中加入Al2(SO4)3和NaOH稀溶液,其中NaOH稀溶液的作用是沉淀铝离子和铜离子;
(4)电解精炼银的原理是利用电解池中粗银做阳极,精银作阴极,含银离子的电解质溶液做电解质溶液;
(5)若产品CuAlO2能溶于浓硝酸发生氧化还原反应,亚铜离子被氧化为铜离子,硝酸钡还原为二氧化氮,结合原子守恒配平书写化学方程式,若有1 mol CuAlO2参与反应,生成气体的体积(标准状况下)小于22.4L,可能是二氧化氮转化为四氧化二氮,或生成一氧化氮气体;
解答 解:由工艺流程图可知,废料在空气中熔炼时,Cu被氧化,滤渣中含有CuO及少量Ag,向滤渣中加入硫酸进行酸浸,CuO与硫酸反应,过滤得到硫酸铜溶液(含有硫酸),滤渣A为Ag;向滤液中加入硫酸铝、氢氧化钠,得到氢氧化铝、氢氧化铜,灼烧中会得到CuO、Al2O3,二者反应得到CuAlO2,银熔体冷却成型得到粗银,通过电解精炼得到银,
(1)废料在空气中熔炼时,Cu被氧化,滤渣中含有CuO及少量Ag,元素化合价升高的被氧化得到氧化产物CuO,
故答案为:CuO;
(2)向滤渣中加入硫酸进行酸浸,CuO与硫酸反应,过滤得到硫酸铜溶液(含有硫酸),滤渣A为Ag;等物质的量的Al(OH)3与Cu(OH)2在惰性气体中煅烧时生成氧化铜、氧化铝,依据生成产物有CuAlO2,反应前Cu为+2价,反应后为+1,化合价降低1,Al化合价没有变化,所以氧元素的化合价升高,生成氧气,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,
故答案为:Ag;O2;
(3)向CuSO4溶液中加入Al2(SO4)3和NaOH稀溶液,其中NaOH稀溶液的作用是沉淀铝离子和铜离子生成氢氧化铝和氢氧化铜沉淀,
故答案为:使铝离子和铜离子沉淀完全;
(4)电解精炼银的原理是利用电解池中粗银做阳极,精银作阴极,含银离子的电解质溶液做电解质溶液,选择硝酸银溶液做电解质溶液,
故答案为:AgNO3溶液;粗银;
(5)若产品CuAlO2能溶于浓硝酸发生氧化还原反应,亚铜离子被氧化为铜离子,硝酸钡还原为二氧化氮,结合电子守恒、原子守恒配平书写化学方程式为:CuAlO2+6HNO3(浓)=Cu(NO3)2+Al(NO3)3+NO2↑+3H2O,可能是生成的二氧化氮转化为四氧化二氮,随硝酸浓度减小变稀后会生成一氧化氮都可能导致生成气体的体积(标准状况下)小于22.4L,
故答案为:CuAlO2+6HNO3(浓)=Cu(NO3)2+Al(NO3)3+NO2↑+3H2O;二氧化氮转化为四氧化二氮;生成了一氧化氮;
点评 本题考查了物质分离提纯的过程分析,主要是物质性质、电解原理、氧化还原反应电子守恒、等知识点的理解应用,题目难度中等.

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案| A. | 氯分子的电子式: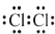 | B. | 氯离子(Cl-)的结构示意图: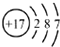 | ||
| C. | 中子数为20的氯原子: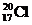 | D. | 氯乙烯分子的结构简式:H3C-CH2Cl |
| A. | 甲基的电子式: | B. | 氮原子的电子排布图: | ||
| C. | 淀粉的实验式:CH2O | D. | 聚乙炔结构简式: |
 ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:
ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:| 信息 | 内容 |
| ① | ClO2为黄绿色气体,极易溶于水,熔点为-59℃,沸点为11℃,具有强氧化性 |
| ② | ClO2易爆炸,若用惰性气体等稀释,则爆炸的可能性大降低 |
| ③ | HClO4、HClO2均是强酸,HClO4为无色透明液体,沸点为90℃;HClO2很不稳定,容易分解 |
(2)装置C的作用是防止倒吸,装置B中用冰水浴的目的是冷凝并分离出二氧化氯.
(3)工业上生产HClO4和NaClO2的工艺流程如图所示.

①操作2的名称是蒸馏;
②设计简单实验证明HClO2为弱酸:在常温下测定NaClO2溶液的PH值,若PH值大于7,则为HClO2弱酸.
(4)ClO2很不稳定,需用随制,产物用水吸收得到ClO2溶液,为测定所得溶液中ClO2的含量,进行下列实验:
步骤1:准确量取V1 mLClO2溶液于锥形瓶中.
步骤2:用稀硫酸调节ClO2溶液的pH≤2.0,加入足量的KI晶体,静置片刻.
步骤3:加入指示剂,用c mol•L-1•的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL.
实验中加入的指示剂是淀粉溶液,达到滴定终点时的现象是溶液由蓝色变为无色,且保持30s不变.
原溶液中ClO2的含量为$\frac{13.5cV{\;}_{2}}{V{\;}_{1}}$g/L(用含字母的代数式表示)g•L-1.(已知:2ClO2+8H++10I-═2Cl-+5I2+4H2,2S2O32-+I2═2I-+S2O32-)
①Si ②Al ③Cl ④Fe ⑤Na.
| A. | ①②⑤ | B. | ①② | C. | ①②③ | D. | ①②③⑤ |
| A. | 反应速率:乙>甲 | B. | 平衡时C的体积分数:乙>甲 | ||
| C. | 平衡时C的转化率:乙>甲 | D. | 平衡时A的物质的量:甲>乙 |
| A. | CH3COO- | B. | SO32- | C. | CO32- | D. | HCO3- |
4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g);△H
4N2(g)+6H2O(g);△H副反应及773K时平衡常数如表所示
| 反应 | △H(kJ•mol-1) | 平衡常数(K) |
| 4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g) | -905.5 | 1.1×1026mol•L-1 |
| 4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g) | -1104.9 | 4.4×1028 |
| 4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g) | -1269.0 | 7.1×1034L•mol-1 |
(2)图2表示在密闭体系中进行实验,起始投入一定量NH3、NO、O2,测定不同温度下,在相同时间内各组分的浓度.
①图中a、b、c三点,主反应速率最大的是c
②试解释N2浓度曲线先上升后下降的原因先上升:反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓度越大;后下降:达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动,且随温度升高有副产物的生成,N2浓度降低.
③550K时,欲提高N2O的百分含量,应采取的措施是采用合适的催化剂
(3)电化学催化净化NO是一种最新脱硝方法.原理示意图如图1,固体电解质起到传导O2-的作
用.
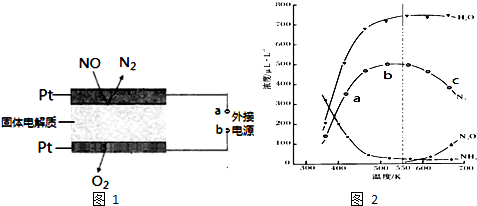
A为外接电源的负极(填“正”、“负”).通入NO的电极反应式为2NO+4e-=N2+2O2-.
