题目内容
2.海洋是一个丰富的资宝库,通过海水的综合利用可获得许多物质供人类使用.(1)海水中盐的开发利用:
①海水制盐目前以盐田法为t,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩.所建盐田分为贮水池、蒸发池和结晶池.
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用:阻止H2与Cl2发生反应甚至发生爆炸或阻止Cl2与生成的NaOH溶液反应而使烧碱产品不纯等(写一点即可).
(2)电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图1所示.其中具有选择性的阴离子交换膜和阳离子交换膜相间排列.请回答下面的问题:
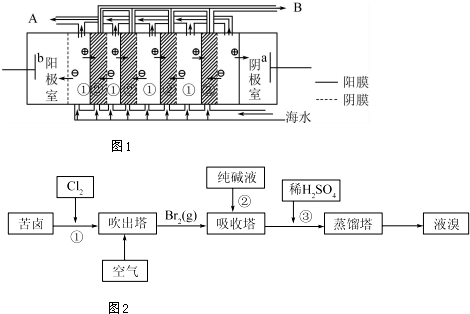
①海水不能直接通人到阴极室中,理由是海水中含较多Mg2+和Ca2+等阳离子,电解时会产生Mg(OH)2、Ca(OH)2等沉淀从而堵塞阳离子交换膜.
②A口排出的是淡水(填“淡水”或“浓水”)
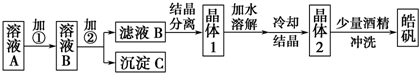
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如图2
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为:3CO32-+3Br2=5Br-+BrO3-+3CO2↑
②通过①氯化已获得含Br2的溶液.为何还需经过吹出、吸收、酸化重新获得含Br2的溶液?
③向蒸馏塔中通入水蒸气加热.控制温度在90℃左右进行蒸馏的原因是温度过低难以将Br2蒸馏出来,但温度过高又会将大量的水蒸馏出来.
分析 (1)①海水晒盐通过蒸发、结晶制取食盐;
②阳离子交换膜只能阳离子通过,阴离子和气体不能通过;
(2)①海水中含有的Mg2+和Ca2+等阳离子易和氢氧根离子反应生成沉淀;
②在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,离子浓度大的为浓水,离子浓度小的为淡水.
(3)①吸收塔中碳酸根离子与溴单质反应生成溴离子、溴酸根离子和二氧化碳气体,反应③加入硫酸后,Br-、BrO3-反应生成溴单质,据此写出反应的离子方程式;
②在①中溴单质浓度较小,通过吹出、吸收、酸化重新获得含Br2的溶液,可以富集溴,降低成本;
③温度过高会导致水蒸气蒸发出来,温度过低无法将溴蒸发出来.
解答 解:(1)①海水晒盐需要通过蒸发、结晶过程,所以还需要结晶池,
故答案为:结晶;
②阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电解电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯,
故答案为:阻止H2与Cl2发生反应甚至发生爆炸或阻止Cl2与生成的NaOH溶液反应而使烧碱产品不纯等;
(2)①海水中含有海水中含较多Mg2+和Ca2+等阳离子,电解时阴极附近生成氢氧根离子,导致氢氧根离子和钙镁离子反应生成Mg(OH)2、Ca(OH)2等沉淀从而堵塞阳离子交换膜,从而抑制离子通过,导致电渗析法失败,
故答案为:海水中含较多Mg2+和Ca2+等阳离子,电解时会产生Mg(OH)2、Ca(OH)2等沉淀从而堵塞阳离子交换膜;
②在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,①室离子浓度变小,②室离子浓度不大,离子浓度大的为浓水,所以浓水在B处排出,淡水在A处排出,
故答案为:淡水;
(3)①纯碱是碳酸钠,与溴反应有BrO3-生成,反应的离子方程式为:3CO32-+3Br2=5Br-+BrO3-+3CO2↑,
故答案为:3CO32-+3Br2=5Br-+BrO3-+3CO2↑;
②从①出来的溶液中溴的含量不高,如果直接蒸馏,产品成本高,所以需要进一步浓缩溴,提高溴的浓度,
故答案为:富集溴,提高Br2的浓度;
③温度过高水蒸气蒸出,溴中含有水分,温度过低溴不能完全蒸出,产率低,
故答案为:温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来.
点评 本题考查海水的综合利用,题目难度中等,明确图片内涵、生成流程为解本题关键,(2)中需要明确阳离子在电极上放电,导致排出的水为淡水,从而实现海水淡化.

 阅读快车系列答案
阅读快车系列答案 铝-空气电池以高纯度铝(含铝99.99%)为负极,氧气为正极,以KOH溶液为电解质溶液.如图为某铝-空气电池工作的原理示意图,下列有关说法正确的是( )
铝-空气电池以高纯度铝(含铝99.99%)为负极,氧气为正极,以KOH溶液为电解质溶液.如图为某铝-空气电池工作的原理示意图,下列有关说法正确的是( )| A. | 铝-空气电池要及时回收处理,以免造成重金属污染 | |
| B. | 每消耗1molAl,电解质溶液中会有3 mol电子通过 | |
| C. | 负极上的电极反应式为:Al-3e-+4OH-═AlO2-+2H2O | |
| D. | 电池总反应式为:Al+KOH+O2═KAlO2+H2O |
| R | T | |
| X | Y | Z |
| A. | 气态氢化物稳定性:Y>T | |
| B. | R能分别与X、Z形成共价化合物 | |
| C. | R位于元素周期表中第二周期第VA族 | |
| D. | Z元素的最高价氧化物对应的水化物的化学式为HZO4 |
| A. | 由于非金属性Y>R,所以X、Y组成化合物的沸点高于X、R组成的化合物 | |
| B. | Y和其他四种元素均可形成至少两种的二元化合物 | |
| C. | RY2能与Y、Z形成的一种化合物反应生成Y2 | |
| D. | Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
| A. | 用惰性电极电解含酚酞的饱和食盐水,阳极附近溶液先变红 | |
| B. | 铜的电解精炼过程中,有0.2 mol 电子发生转移时,阳极一定有6.4 g铜溶解 | |
| C. | 将地下钢管与直流电源的正极相连,称为外加电源的阴极保护法 | |
| D. | 在中性环境中,每生成35.6 g铁锈(Fe2O3•H2O),消耗的氧气为6.72 L(标准状况) |
| A. | “西气东输”中的“气”指的是煤气 | |
| B. | 我国使用最早的合金为青铜,主要成分是 Cu 和 Sn | |
| C. | 自然界存在大量游离态的硫及硅 | |
| D. | 氮是动植物生长不可缺少的元素,是油脂的组成元素之一 |

 .
.