题目内容
10.短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24.则下列判断正确的是( )| R | T | |
| X | Y | Z |
| A. | 气态氢化物稳定性:Y>T | |
| B. | R能分别与X、Z形成共价化合物 | |
| C. | R位于元素周期表中第二周期第VA族 | |
| D. | Z元素的最高价氧化物对应的水化物的化学式为HZO4 |
分析 由短周期元素R、T、X、Y、Z在元素周期表的相对位置,R、T应在第二周期,X、Y、Z应在第三周期,设R的最外层电子数为x,则T、Y的最外层电子数为x+1,Z的最外层电子数为x+2,它们的最外层电子数之和为24,则x+x+(x+1)×2+x+2=24,解得x=4,则R为C,X为Si,T为N,Y为P,Z为S,然后结合元素性质及周期律来解答.
解答 解:由短周期元素R、T、X、Y、Z在元素周期表的相对位置,R、T应在第二周期,X、Y、Z应在第三周期,设R的最外层电子数为x,则T、Y的最外层电子数为x+1,Z的最外层电子数为x+2,它们的最外层电子数之和为24,则x+x+(x+1)×2+x+2=24,解得x=4,则R为C,X为Si,T为N,Y为P,Z为S,
A.非金属性Y<T,则气态氢化物稳定性:Y<T,故A错误;
B.C与Si、S分别形成SiC,CS2,都是共价化合物,故B正确;
C.R为C,位于元素周期表中第二周期第ⅣA族,故C错误;
D.Z为S,最高价为+6价,Z元素的最高价氧化物对应的水化物的化学式为H2ZO4,故D错误;
故选:B.
点评 本题考查位置、结构、性质的关系及应用,为高频考点,元素的推断为解答的关键,注意利用元素的位置及最外层电子数推断元素,把握元素周期律即可解答,题目难度中等.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
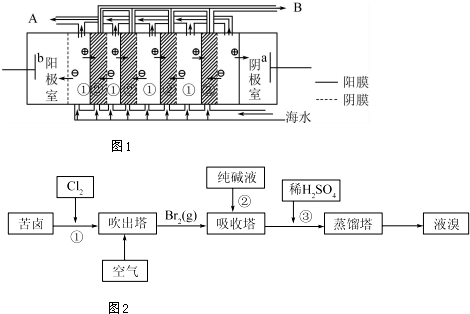
18. 物质结构与性质包括原子、分子和晶体结构与性质三大内容.请回答下列问题:
物质结构与性质包括原子、分子和晶体结构与性质三大内容.请回答下列问题:
(1)写出基态Fe原子的电子排布图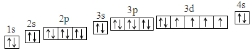 ;第ⅦA族元素原子外围电子排布通式为ns2np5.
;第ⅦA族元素原子外围电子排布通式为ns2np5.
(2)在Al、N、O三种元素中,第一电离能由大到小的排序是N>O>Al;原子半径最大的元素和离子半径最大的元素所组成的物质是AlN(填化学式).
(3)已知几种元素的电负性如下表:
①在上表所列的元素中,在氢化物中H元素化合价显负价的是SiH4、B2H6(填简单氢化物的分子式).
②B3N3H6与苯互为等电子体,其结构式为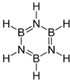 ,能发生加成反应、取代反应(填有机反应类型).
,能发生加成反应、取代反应(填有机反应类型).
③NF3在微电子工业中可作为一种优良的等离子蚀刻气体,其结构与NH3相似,但熔沸点比NH3低很多,其原因是氨分子间能形成氢键,且极性比NF3强,而NF3分子间不能形成氢键.
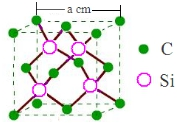
④金刚砂(SiC)硬度仅次于金刚石,可用作砂纸、砂轮的磨料,其晶胞(立方体)如图:则硅原子的杂化类型为sp3,其密度为$\frac{160}{{N}_{A}•{a}^{3}}$g/cm3(以含a的代数式表示).
 物质结构与性质包括原子、分子和晶体结构与性质三大内容.请回答下列问题:
物质结构与性质包括原子、分子和晶体结构与性质三大内容.请回答下列问题:(1)写出基态Fe原子的电子排布图
 ;第ⅦA族元素原子外围电子排布通式为ns2np5.
;第ⅦA族元素原子外围电子排布通式为ns2np5.(2)在Al、N、O三种元素中,第一电离能由大到小的排序是N>O>Al;原子半径最大的元素和离子半径最大的元素所组成的物质是AlN(填化学式).
(3)已知几种元素的电负性如下表:
| H | B | C | N | O | F |
| 2.18 | 2.04 | 2.55 | 3.04 | 3.44 | 3.98 |
| Si | P | S | Cl | ||
| 1.90 | 2.19 | 2.58 | 3.16 |
②B3N3H6与苯互为等电子体,其结构式为
 ,能发生加成反应、取代反应(填有机反应类型).
,能发生加成反应、取代反应(填有机反应类型).③NF3在微电子工业中可作为一种优良的等离子蚀刻气体,其结构与NH3相似,但熔沸点比NH3低很多,其原因是氨分子间能形成氢键,且极性比NF3强,而NF3分子间不能形成氢键.
| 氨 | 三氟化氮 | |
VSEPR模 型 | 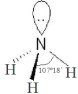 | 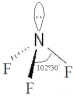 |
| 熔点/℃ | -77.7 | -206.8 |
| 沸点/℃ | -33.5 | -129.0 |
15. 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
(1)该反应的平衡常数表达是$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)•c({O}_{2})}$;800℃反应达到平衡时,NO的物质的量浓度
是0.0035mol/L;升高温度,NO的浓度增大,则该反应是放 (填“放热”或“吸
热”)反应.
(2)如图中表示NO2变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s)或1.5×10-3mol/(L•s).
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(5)已知:25℃、101kPa时,①Mn(s)+O2(g)═MnO2(s)△H1=-520kJ/mol
②S(s)+O2(g)═SO2(g)△H2=-297kJ/mol
③Mn(s)+S(s)+2O2(g)═MnSO4(s)△H3=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
是0.0035mol/L;升高温度,NO的浓度增大,则该反应是放 (填“放热”或“吸
热”)反应.
(2)如图中表示NO2变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s)或1.5×10-3mol/(L•s).
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(5)已知:25℃、101kPa时,①Mn(s)+O2(g)═MnO2(s)△H1=-520kJ/mol
②S(s)+O2(g)═SO2(g)△H2=-297kJ/mol
③Mn(s)+S(s)+2O2(g)═MnSO4(s)△H3=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol.
19. 纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂.目前主要的合成方法有电解法、高温固相法等.
纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂.目前主要的合成方法有电解法、高温固相法等.
(1)有研究表明阳极氧化法成功制得了Cu2O 纳米阵列,装置如图:该电池的阳极反应方程式为2Cu-2e-+2OH-=Cu2O+H2O离子交换膜为阴(填阳或阴)离子交换膜,铜网应连接电源的正极.
(2)在高温下用甲烷将粉状CuO 还原也可制得Cu2O.
已知:①2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s);△H=-169kJ•mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-846.3kJ•mol-1
③Cu(s)+$\frac{1}{2}$O2(g)=CuO(s);△H=-157kJ•mol-1
则该反应的热化学方程式是:8CuO(s)+CH4(g)=4Cu2O(s)+CO2(g)+2H2O(g)△H=-266.3kJ/mol.
(3)在相同的密闭容器中,用等质量的三种纳米Cu2O(用不同方法制得)分别进行催化分解水的实验:2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0.水蒸气浓度随时间t变化如下表所示:
①对比实验的温度:T2>T1(填“>”“<”或“﹦”),原因是因为该反应的正反应方向为吸热方向,升温,平衡正向移动,平衡常数增大,③的平衡常数大于①,说明T2大于T1.
②实验①前20min的平均反应速率 v(O2)=3.5×10-5mol/(L•min)
③比较不同方法制得的Cu2O的催化效果应选用①和②组实验,原因是除催化剂外,其他条件相同.
 纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂.目前主要的合成方法有电解法、高温固相法等.
纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂.目前主要的合成方法有电解法、高温固相法等.(1)有研究表明阳极氧化法成功制得了Cu2O 纳米阵列,装置如图:该电池的阳极反应方程式为2Cu-2e-+2OH-=Cu2O+H2O离子交换膜为阴(填阳或阴)离子交换膜,铜网应连接电源的正极.
(2)在高温下用甲烷将粉状CuO 还原也可制得Cu2O.
已知:①2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s);△H=-169kJ•mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-846.3kJ•mol-1
③Cu(s)+$\frac{1}{2}$O2(g)=CuO(s);△H=-157kJ•mol-1
则该反应的热化学方程式是:8CuO(s)+CH4(g)=4Cu2O(s)+CO2(g)+2H2O(g)△H=-266.3kJ/mol.
(3)在相同的密闭容器中,用等质量的三种纳米Cu2O(用不同方法制得)分别进行催化分解水的实验:2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0.水蒸气浓度随时间t变化如下表所示:
| 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
②实验①前20min的平均反应速率 v(O2)=3.5×10-5mol/(L•min)
③比较不同方法制得的Cu2O的催化效果应选用①和②组实验,原因是除催化剂外,其他条件相同.
5.如图实验现象预测正确的是( )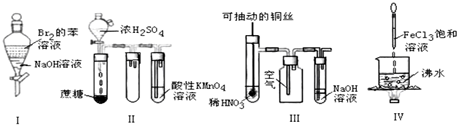

| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 | |
| B. | 实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 实验Ⅳ:向沸水中滴加FeCl3溶液,继续煮沸溶液至红褐色,就可以制备FeCl3胶体 |
 ; NH3的VSEPR模型为正四面体;请解释加入乙醇后析出晶体的原因乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度.
; NH3的VSEPR模型为正四面体;请解释加入乙醇后析出晶体的原因乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度. .乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高.
.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高.
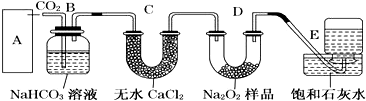
 近年来,我国北方地区雾霾频发.引起雾霾的PM2.5微细粒子包含(NH4)2 SO4、NH4NO3、有机微粒物及扬尘等,通过测定雾霾中锌等重金属的含量,可知交通污染是目前造成雾霾天气的主要原因之一,回答下列问题:
近年来,我国北方地区雾霾频发.引起雾霾的PM2.5微细粒子包含(NH4)2 SO4、NH4NO3、有机微粒物及扬尘等,通过测定雾霾中锌等重金属的含量,可知交通污染是目前造成雾霾天气的主要原因之一,回答下列问题: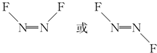 ,1molN2F2分子中所含σ键的数目是3NA.
,1molN2F2分子中所含σ键的数目是3NA.