题目内容
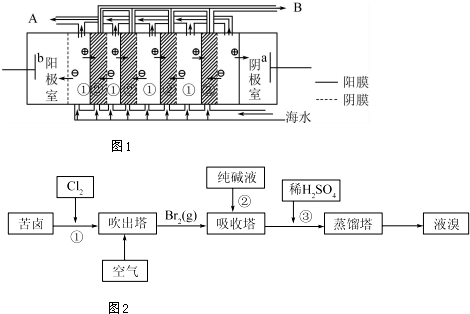
2. 铝-空气电池以高纯度铝(含铝99.99%)为负极,氧气为正极,以KOH溶液为电解质溶液.如图为某铝-空气电池工作的原理示意图,下列有关说法正确的是( )
铝-空气电池以高纯度铝(含铝99.99%)为负极,氧气为正极,以KOH溶液为电解质溶液.如图为某铝-空气电池工作的原理示意图,下列有关说法正确的是( )| A. | 铝-空气电池要及时回收处理,以免造成重金属污染 | |
| B. | 每消耗1molAl,电解质溶液中会有3 mol电子通过 | |
| C. | 负极上的电极反应式为:Al-3e-+4OH-═AlO2-+2H2O | |
| D. | 电池总反应式为:Al+KOH+O2═KAlO2+H2O |
分析 KOH溶液为电解质溶液,铝空气燃料电池中负极反应为Al+4OH--3e-═AlO2-+2H2O,正极反应为O2+2H2O+4e-=4OH-,总反应为4Al+4OH-+3O2═4AlO2-+2H2O,以此解答.
解答 解:A.电池要及时回收处理,是正确的,但铝不是重金属,故A错误;
B.原电池工作时,电子在外电路中从负极沿导线流到正极,电解质溶液中是阴阳离子作定向移动,总之电子一定不能通过溶液,故B错误;
C.铝作负极,铝失去电子变为铝离子,在氢氧化钾的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为:Al-3e-+4OH-═AlO2-+2H2O,故C正确;
D.负极反应为Al+4OH--3e-═AlO2-+2H2O,正极反应为O2+2H2O+4e-=4OH-,总反应为4Al+4OH-+3O2═4AlO2-+2H2O,即4Al+4KOH+3O2═4KAlO2+2H2O,故D错误;
故选:C.
点评 本题考查化学电源新型电池,注意在电池中负极上失电子发生氧化反应,氧化剂在正极上得电子发生还原反应,注意电解质的作用,难度适中.

练习册系列答案
相关题目
12.X、Y、Z、W、M均为短周期元素,X、Y处于同一周期,Z、W处于同一周期,X、Y 原子最外层电子数之和等于Z、W 原子最外层电子数之和,Y 是形成化合物种类最多的元素,X、W 的简单离子X2-、W3+具有相同的电子层结构,M为短周期中除稀有气体元素外原子半径最大的元素.下列说法正确的是( )
| A. | X最高价氧化物对应的水化物为强酸 | |
| B. | 原子半径大小顺序为M>W>X>Y>Z | |
| C. | 水溶液中Z 的简单单核离子能促进水的电离 | |
| D. | Z、M的最高价氧化物对应的水化物均能溶解W与X形成的化合物 |
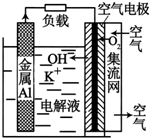
13.如表叙述不正确的是( )
| A | B | C | D |
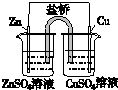 | 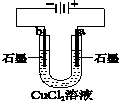 |  |  |
| 盐桥中的Cl-移向ZnSO4溶液 | a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 | 粗铜的电极反应式为:Cu2++2e-=Cu | 正极反应式为: O2+4e-+2H2O=4OH- |
| A. | A | B. | B | C. | C | D. | D |
17.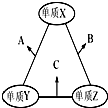 X、Y、Z三种短周期元素,原子半径的大小关系为:r (Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法不正确的是( )
X、Y、Z三种短周期元素,原子半径的大小关系为:r (Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法不正确的是( )
 X、Y、Z三种短周期元素,原子半径的大小关系为:r (Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法不正确的是( )
X、Y、Z三种短周期元素,原子半径的大小关系为:r (Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法不正确的是( )| A. | X元素位于ⅥA族 | B. | A难溶于B中 | ||
| C. | A和C不可能发生氧化还原反应 | D. | B的沸点高于C的沸点 |
14.下列实验设计正确的是( )
| A. | 将SO2通入溴水中证明SO2具有漂白性 | |
| B. | 将铁屑放入稀HNO3中证明Fe比H2活泼 | |
| C. | 将澄清石灰水滴入某溶液证明其中存在CO32- | |
| D. | 将乙烯通入KMnO4酸性溶液证明乙烯具有还原性 |
 ; NH3的VSEPR模型为正四面体;请解释加入乙醇后析出晶体的原因乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度.
; NH3的VSEPR模型为正四面体;请解释加入乙醇后析出晶体的原因乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度. .乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高.
.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高.
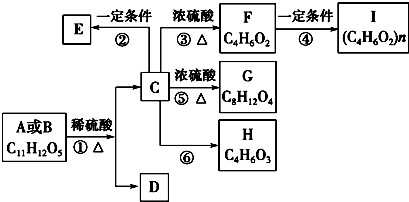
 .
.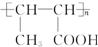
 .
. .
.