题目内容
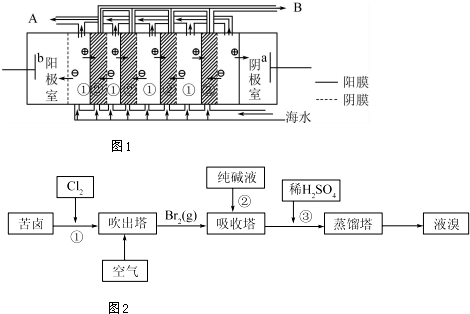
17.化学实验室通常用粗锌和稀硫酸反应制取氢气,因此在制氢废液中含有大量的硫酸锌.同时,由于粗锌中还含有铁等杂质,使得溶液中还混有一定量的硫酸亚铁.工业上为了充分利用制氢废液,常用其制备皓矾(ZnSO4•7H2O).某校化学兴趣小组的同学以制氢废液为原料来制取皓矾.其实验流程如图所示: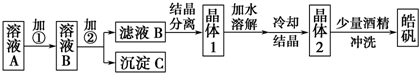
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围如下:Fe(OH)3:2.7~3.7 Fe(OH)2:7.6~9.6 Zn(OH)2:5.7~8.0
试回答下列问题:
(1)加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸,最好选用20%的H2O2,其理由是将制氢废液中的Fe2+氧化为Fe3+,同时避免引入新的杂质;
(2)加入的试剂②,供选择使用的有:a.Zn粉,b.ZnO,c.Zn(OH)2,d.ZnCO3,e.ZnSO4,可选用bcd;
(3)从晶体1→晶体2,该过程的名称是重结晶;
(4)在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因为了冲洗掉晶体表面的杂质离子,防止晶体溶解,影响产率.
分析 由题意可知溶液A含有亚铁离子、锌离子,依据开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8,直接沉淀亚铁离子,锌离子也会全部全部沉淀,不能实现实验目的和要求,应先要先把亚铁离子氧化为铁离子,调节溶液PH使三价铁离子全部沉淀,此时锌离子不沉淀,加入的氧化剂不能引入新的杂质,通常用20%的H2O2 然后加入ZnO[ZnCO3或Zn(OH)2)]以调节溶液的pH至3.7-5.7,使得Fe3+完全转化为Fe(OH)3沉淀,同时避免引入新的杂质,过滤后将滤液进行蒸发浓缩、冷却结晶可得到ZnSO4•7H2O,洗涤晶体时,为避免晶体溶解,可用酒精进行洗涤,以此解答该题.
解答 解:由题意可知溶液A含有亚铁离子、锌离子,依据开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8,直接沉淀亚铁离子,锌离子也会全部全部沉淀,不能实现实验目的和要求,应先要先把亚铁离子氧化为铁离子,调节溶液PH使三价铁离子全部沉淀,此时锌离子不沉淀,加入的氧化剂不能引入新的杂质,通常用20%的H2O2 然后加入ZnO[ZnCO3或Zn(OH)2)]以调节溶液的pH至3.7-5.7,使得Fe3+完全转化为Fe(OH)3沉淀,同时避免引入新的杂质,过滤后将滤液进行蒸发浓缩、冷却结晶可得到ZnSO4•7H2O,洗涤晶体时,为避免晶体溶解,可用酒精进行洗涤,
(1)由以上分析可知试剂①应为过氧化氢,可将制氢废液中的Fe2+氧化为Fe3+,同时避免引入新的杂质,
故答案为:20%的H2O2;将制氢废液中的Fe2+氧化为Fe3+,同时避免引入新的杂质;
(2)试剂②是用来调节溶液PH到至3.7-5.7,目的让铁离子全部沉淀,除杂实验不能引入新的杂质;Zn粉会把氧化得到的铁离子还原,起不到除去的作用,ZnO、Zn(OH)2、ZnCO3可以反应调节溶液PH到至3.7-5.7,使铁离子沉淀,同时不引入新的杂质,ZnSO4不能调节溶液PH,且引入杂质硫酸根离子,
故答案为:bcd;
(3)晶体溶解再结晶是提纯晶体的方法为重结晶,故答案为:重结晶;
(4)涤晶体表面的杂质离子,同时减少皓钒晶体的损失;在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是,晶体溶于水,不溶于酒精,所以目的是为了冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率,
故答案为:为了冲洗掉晶体表面的杂质离子,防止晶体溶解,影响产率.
点评 本题综合考查物质的制备、分离、提纯等知识,侧重于学生的分析能力、实验能力的考查,为高考常见题型,注意把握实验的操作原理和步骤,把握相关物质的性质,难度中等.

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案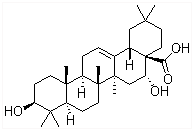 刺囊酸具有滋肝补血、凉血止血功能,结构式如图所示.下列关于刺囊酸的说法不正确的是( )
刺囊酸具有滋肝补血、凉血止血功能,结构式如图所示.下列关于刺囊酸的说法不正确的是( )| A. | 和氧所催化氧化后产物中含有醛基 | B. | 能和NaHCO3溶液反应生成CO2 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 能发生取代、氧化、加成等反应 |
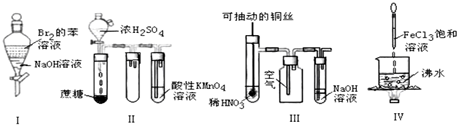
| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 | |
| B. | 实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 实验Ⅳ:向沸水中滴加FeCl3溶液,继续煮沸溶液至红褐色,就可以制备FeCl3胶体 |
| A. | 碳原子数≤10 的烷烃,其一氯代物没有同分异构体的烷烃共有3种 | |
| B. | 烯烃、炔烃、芳香烃都能与溴水反应而使其褪色 | |
| C. | 等质量的CH≡CH和C6H6完全燃烧时消耗等物质的量的氧气 | |
| D. | 分子式为C6H12与C3H6的两种烃一定互为同系物 |
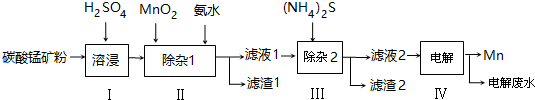
已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为Fe(OH)3(填化学式).已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2OFe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+.
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失.
(4)滤液2中,c(Co2+):c(Ni2+)=5:1.
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg.若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为$\frac{(b-\frac{c}{107}×\frac{1}{2}×55)×\frac{115}{55}}{a}$×100%.(用含a、b、c的式子表达,无需化简)