题目内容
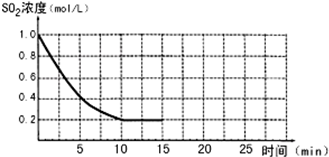 已知:2SO2(g)+O2(g)?2SO3(g);△H=-196kJ/mol,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图.
已知:2SO2(g)+O2(g)?2SO3(g);△H=-196kJ/mol,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图.回答下列问题
(1)前10分钟内O2的平均反应速率为
(2)平衡时,02的转化率为
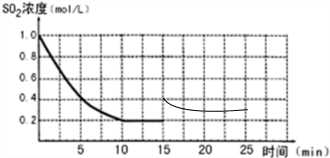
(3)若15分钟时维持温度不变,压缩容器体积,使其体积变为1L,假设在20分钟时达到新平衡,此时c(O2)=1.15mol/L,请在图上画出15-25分钟SO2的浓度变化曲线.
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)图象分析计算二氧化硫反应速率,V=
计算,反应速率之比等于化学方程式计量数之比计算氧气反应速率;
(2)图象分析,二氧化硫反应物质的量=(1.0-0.2)mol/L×2L=1.6mol,反应的氧气物质的量为0.8mol,平衡状态氧气浓度=
=0.6mol/L,依据热化学方程式计算反应放热,转化率=
×100%;
(3)压缩体积为1L,压强增大,平衡正向进行,二氧化硫浓度增大为原来一倍0.4mol/L,氧气浓度变化为1.2mol/L,达到平衡状态c(O2)=1.15mol/L,反应消耗氧气浓度为0.05mol/L,消耗二氧化硫浓度0.1mol/L,随反应进行达到平衡状态减小到0.3mol/L,依据数据绘制变化图象;
| △c |
| △t |
(2)图象分析,二氧化硫反应物质的量=(1.0-0.2)mol/L×2L=1.6mol,反应的氧气物质的量为0.8mol,平衡状态氧气浓度=
| 2mol-0.8mol |
| 2L |
| 消耗量 |
| 起始量 |
(3)压缩体积为1L,压强增大,平衡正向进行,二氧化硫浓度增大为原来一倍0.4mol/L,氧气浓度变化为1.2mol/L,达到平衡状态c(O2)=1.15mol/L,反应消耗氧气浓度为0.05mol/L,消耗二氧化硫浓度0.1mol/L,随反应进行达到平衡状态减小到0.3mol/L,依据数据绘制变化图象;
解答:
解:(1)图象分析,前10分钟内二氧化硫浓度变化为1.0mol/L-0.2mol/L=0.8mol/L,反应速率V(SO2)=
=0.08mol/L?min;
V(O2)=
V(SO2)=
×0.08mol/L?min=0.04mol/L?min;
故答案为:0.04mol/L?min;
(2)图象分析,二氧化硫反应物质的量=(1.0-0.2)mol/L×2L=1.6mol,反应的氧气物质的量为0.8mol,平衡时,02的转化率=
×100%=40%;2SO2(g)+O2(g)?2SO3(g);△H=-196kJ/mol,依据化学方程式计算反应放热=196KJ/mol×0.8mol=156.8KJ;
故答案为:40%,156.8KJ;
(3)压缩体积为1L,压强增大,平衡正向进行,二氧化硫浓度增大为原来一倍0.4mol/L,氧气浓度变化为1.2mol/L,达到平衡状态c(O2)=1.15mol/L,反应消耗氧气浓度为0.05mol/L,消耗二氧化硫浓度0.1mol/L,随反应进行达到平衡状态减小到0.3mol/L,绘制图象得到:
 ;
;
故答案为:
| 0.8mol/L |
| 10min |
V(O2)=
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:0.04mol/L?min;
(2)图象分析,二氧化硫反应物质的量=(1.0-0.2)mol/L×2L=1.6mol,反应的氧气物质的量为0.8mol,平衡时,02的转化率=
| 0.8mol |
| 2mol |
故答案为:40%,156.8KJ;
(3)压缩体积为1L,压强增大,平衡正向进行,二氧化硫浓度增大为原来一倍0.4mol/L,氧气浓度变化为1.2mol/L,达到平衡状态c(O2)=1.15mol/L,反应消耗氧气浓度为0.05mol/L,消耗二氧化硫浓度0.1mol/L,随反应进行达到平衡状态减小到0.3mol/L,绘制图象得到:
 ;
;故答案为:

点评:本题考查了化学平衡影响因素,反应速率影响因素和计算分析,图象变化特征分析和图象绘制是解题关键,题目难度中等.

练习册系列答案
相关题目
下列离子方程式正确的是( )
A、MnO2与浓盐酸反应制Cl2:MnO2+4HCl
| ||||
| B、Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O | ||||
| C、双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | ||||
| D、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O |
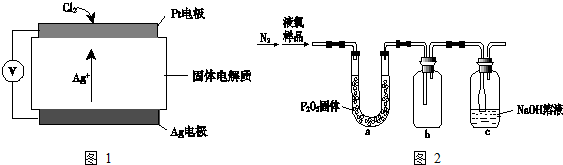
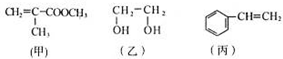 “神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.如图甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法中,错误的是( )
“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.如图甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法中,错误的是( )| A、甲物质可以在引发剂作用下生成有机高分子化合物 |
| B、1mol乙物质可与2mol钠完全反应生成1mol氢气 |
| C、丙物质能够使酸性高锰酸钾溶液退色 |
| D、甲、乙、丙三种物质都可以发生加成反应 |
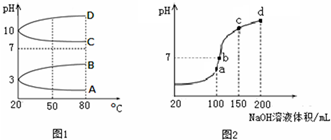
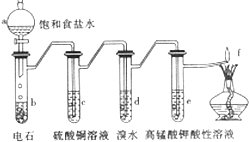 如图是制备和研究乙炔性质的实验装置图.下列说法不正确的是( )
如图是制备和研究乙炔性质的实验装置图.下列说法不正确的是( )| A、制备乙炔的反应原理是:CaC2+2H2O→Ca(OH)2+C2H2↑ |
| B、c的作用是除去影响后续实验的杂质 |
| C、d中的有机产物与AgNO3溶液混合能产生沉淀 |
| D、e中的现象说明乙炔能被高锰酸钾酸性溶液氧化 |
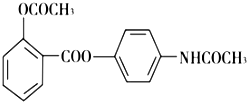 贝诺酯具有抗风湿、解热镇痛作用,其结构简式如图,下列说法正确的是( )
贝诺酯具有抗风湿、解热镇痛作用,其结构简式如图,下列说法正确的是( )| A、贝诺酯可与水任意比互溶 |
| B、贝诺酯完全水解后能得到3种物质 |
| C、1mol贝诺酯最多可与9mol H2发生加成反应 |
| D、贝诺酯可发生取代反应、消去反应和聚合反应 |