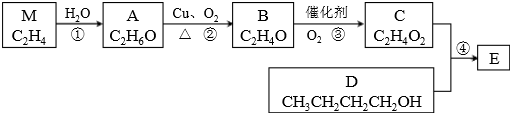
题目内容
8.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:①量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液.
②用标准液滴定至终点,记录滴定管液面读数,所得数据如下表:
| 滴定次数 | 盐酸体积 | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
(1)步骤①中,量取20.00mL待测液应使用酸式滴定管(填仪器名称),若在锥形瓶装液前残留少量蒸馏水,将使测定结果无影响(填“偏大”、“偏小”或“无影响”).
(2)步骤②中,滴定时眼睛应注视锥形瓶(填仪器名称),判断到达滴定终点的依据是滴入最后一滴NaOH溶液,锥形瓶中溶液由无色变为浅红色,半分钟不变色.
(3)第一次滴定记录的NaOH溶液的体积明显多于后两次的体积,其可能的原因是AB(填字母)
A.滴定前滴定管尖嘴有气泡,滴定结束时无气泡
B.锥形瓶装液前用待测液润洗
C.NaOH标准液保存时间过长,有部分Na2CO3生成
D.滴定终点时,俯视读数
(4)根据上表记录数据,通过计算可得该盐酸的浓度为0.1626 mol•L-1.
分析 (1)根据精确量取液体的体积用滴定管;根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$判断不当操作对V(标准)的影响,以此判断;
(2)根据中和滴定中,眼睛应注视的是锥形瓶中溶液颜色变化;根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(3)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$判断不当操作对V(标准)的影响,以此判断;
(4)先根据数据的有效性,舍去第1组数据,然后求出2、3组平均消耗V(NaOH),接着根据NaOH~HCl来计算.
解答 解:(1)精确量取液体的体积用滴定管,量取20.00mL待测液应使用酸式滴定管,若在锥形瓶装液前残留少量蒸馏水,V(标准)不变,c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$判断,c(待测)不变;
故答案为:酸式滴定管;无影响;
(3)中和滴定中,眼睛应注视的是锥形瓶中溶液颜色变化,滴定时,当溶液颜色变化且半分钟内不变色,可说明达到滴定终点,所以当滴入最后一滴NaOH溶液,溶液由无色变为粉红色,且半分钟内不褪色,
故答案为:锥形瓶;滴入最后一滴NaOH溶液,锥形瓶中溶液由无色变为浅红色,半分钟不变色;
(4)从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,上面测得的盐酸浓度偏大,
A.滴定前滴定管尖嘴有气泡,滴定结束时无气泡,导致氢氧化钠溶液体积偏大,所以所测盐酸浓度偏大,故A正确;
B.锥形瓶用待测液润洗,待测液的物质的量偏大,所用氢氧化钠溶液体积偏大,所测盐酸浓度偏大,故B正确
C.NaOH标准液保存时间过长,有部分Na2CO3生成,如用酚酞为指示剂,最终产物不变,没有影响,故C错误;
D.滴定结束时,俯视计数,所用氢氧化钠溶液体积偏小,所测盐酸浓度偏小,故D错误;
故选:AB;
(5)三次滴定消耗的体积为:18.10mL,16.30mL,16.22mL,舍去第1组数据,然后求出2、3组平均消耗V(NaOH)=16.26mL,
NaOH~HCl
1 1
0.2000mol•L-1×16.26mL c(HCl)×20.00mL
解得:c(HCl)=0.1626 mol•L-1;
故答案为:0.1626.
点评 本题考查中和滴定实验、滴定管结构与使用、误差分析以及计算等,难度不大,注意理解中和滴定的原理与滴定管的结构及精度.

| A. | 与漂白粉溶液反应的离子方程式:Ca2++SO32-=CaSO3↓ | |
| B. | 通入HCl至溶液pH=7:c(Na+)=2c(SO32-)+c(HSO3-)+c(Cl-) | |
| C. | 加入NaOH固体可使溶液中水的电离程度增大 | |
| D. | 通入SO2至过量:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] |
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 一定没有甲烷 | D. | 可能有乙烷 |
| A. | 溶液中只含Fe3+、SO42-、Cl- | |
| B. | 溶液中只含Cu2+、SO42- | |
| C. | 需要利用焰色反应才能确定有无Na+ | |
| D. | 溶液中肯定没有I-但无法确定有无Cl- |
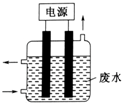
| A. | 该电解装置电极材料均为铁 | |
| B. | 除去CN-的反应:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O | |
| C. | 阴极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O | |
| D. | 该装置排放出的气体主要为N2和CO2 |