题目内容
12.将0.1mol两种气态烃组成的混合气体,完全燃烧后得到3.36L二氧化碳(标准状况下)和3.6g水,下列说法正确的是( )| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 一定没有甲烷 | D. | 可能有乙烷 |
分析 标况下3.36L二氧化碳的物质的量为:n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,3.6g水的物质的量为:n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,
则混合的平均化学式为,C1.5H4,由于是混合物,则肯定含有C原子数小于1.5的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,以此进行解答.
解答 解:标况下3.36L二氧化碳的物质的量为:n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,3.6g水的物质的量为:n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,1mol混合气体完全燃烧生成1.5mol二氧化碳、2mol水,则混合的平均化学式为:C1.5H4,由于两种气态烃的混合物,则一定含有C原子数小于1.5的烃,所以一定含有甲烷,又由于甲烷中含4个氢原子,则另一种烃也含有4个氢原子,
根据以上分析可知,混合气体中一定含有甲烷,所以A正确,C错误,可能含有乙烯,所以B错误,一定没有乙烷,所以D错误,
故选A.
点评 本题考查了有机物分子式的计算,题目难度中等,注意掌握利用平均分子组成判断烃的组成的方法,常用方法有:平均碳法、平均氢法、平均碳氢分子式法、平均式量法等.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 25℃时,将pH=a的一元强酸溶液与pH=14-a的一元碱溶液等体积混合后,所得溶液呈酸性或中性 | |
| B. | 相同温度的盐酸和醋酸两种溶液中,若c(Cl-)=c(CH3COO-),则两溶液pH相同 | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)═c(HCO3-)+c(H2CO3)+2c(H+) | |
| D. | 对于沉淀溶解平衡AgX?Ag++X-,已知AgCl的平衡常数大于AgI.则含AgCl和AgI固体的悬浊液中存在:c(Ag+)>c(I-)>c(Cl-) |
7.下列有关物质(括号内为杂质)的除杂试剂和分离方法均正确的是( )
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 乙醇(乙酸) | KOH溶液 | 分液 |
| C | 苯(苯酚) | NaOH溶液 | 分液 |
| D | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
8.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
①量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液.
②用标准液滴定至终点,记录滴定管液面读数,所得数据如下表:
请回答下列问题:
(1)步骤①中,量取20.00mL待测液应使用酸式滴定管(填仪器名称),若在锥形瓶装液前残留少量蒸馏水,将使测定结果无影响(填“偏大”、“偏小”或“无影响”).
(2)步骤②中,滴定时眼睛应注视锥形瓶(填仪器名称),判断到达滴定终点的依据是滴入最后一滴NaOH溶液,锥形瓶中溶液由无色变为浅红色,半分钟不变色.
(3)第一次滴定记录的NaOH溶液的体积明显多于后两次的体积,其可能的原因是AB(填字母)
A.滴定前滴定管尖嘴有气泡,滴定结束时无气泡
B.锥形瓶装液前用待测液润洗
C.NaOH标准液保存时间过长,有部分Na2CO3生成
D.滴定终点时,俯视读数
(4)根据上表记录数据,通过计算可得该盐酸的浓度为0.1626 mol•L-1.
①量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液.
②用标准液滴定至终点,记录滴定管液面读数,所得数据如下表:
| 滴定次数 | 盐酸体积 | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
(1)步骤①中,量取20.00mL待测液应使用酸式滴定管(填仪器名称),若在锥形瓶装液前残留少量蒸馏水,将使测定结果无影响(填“偏大”、“偏小”或“无影响”).
(2)步骤②中,滴定时眼睛应注视锥形瓶(填仪器名称),判断到达滴定终点的依据是滴入最后一滴NaOH溶液,锥形瓶中溶液由无色变为浅红色,半分钟不变色.
(3)第一次滴定记录的NaOH溶液的体积明显多于后两次的体积,其可能的原因是AB(填字母)
A.滴定前滴定管尖嘴有气泡,滴定结束时无气泡
B.锥形瓶装液前用待测液润洗
C.NaOH标准液保存时间过长,有部分Na2CO3生成
D.滴定终点时,俯视读数
(4)根据上表记录数据,通过计算可得该盐酸的浓度为0.1626 mol•L-1.
 .
.
 .
.

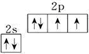 ,氧的第一电离能在同周期元素中由大到小排第4位.
,氧的第一电离能在同周期元素中由大到小排第4位. .
.