题目内容
18.用如所示装置除去含CN-,Cl- 废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无毒的气体,下列说法正确的是( )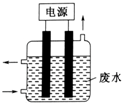
| A. | 该电解装置电极材料均为铁 | |
| B. | 除去CN-的反应:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O | |
| C. | 阴极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O | |
| D. | 该装置排放出的气体主要为N2和CO2 |
分析 除去含CN-,Cl- 废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无毒的气体,反应方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,
A.电解时,活泼金属作阳极,则阳极上金属失电子而不是电解质溶液中阴离子失电子;
B.根据溶液pH、产物成分书写方程式;
C.阴极上次氯酸根离子得电子发生还原反应;
D.生成的两种气体是氮气和二氧化碳.
解答 解:除去含CN-,Cl- 废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无毒的气体,反应方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,
A.电解时,活泼金属作阳极,则阳极上金属失电子而不是电解质溶液中阴离子失电子,则电极材料不能用Fe作阳极,故A错误;
B.根据溶液pH、产物成分书写方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,故B错误;
C.阴极上次氯酸根离子得电子发生还原反应,电极反应式为2H2O+2e-═H2↑+2OH-,故C错误;
D.生成的两种气体是氮气和二氧化碳,故D正确;
故选D.
点评 本题考查电解原理,为高频考点,侧重考查学生获取信息利用信息解答问题能力,正确判断电池反应式是解本题关键,难点是电极、电池反应式的书写,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
①量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液.
②用标准液滴定至终点,记录滴定管液面读数,所得数据如下表:
请回答下列问题:
(1)步骤①中,量取20.00mL待测液应使用酸式滴定管(填仪器名称),若在锥形瓶装液前残留少量蒸馏水,将使测定结果无影响(填“偏大”、“偏小”或“无影响”).
(2)步骤②中,滴定时眼睛应注视锥形瓶(填仪器名称),判断到达滴定终点的依据是滴入最后一滴NaOH溶液,锥形瓶中溶液由无色变为浅红色,半分钟不变色.
(3)第一次滴定记录的NaOH溶液的体积明显多于后两次的体积,其可能的原因是AB(填字母)
A.滴定前滴定管尖嘴有气泡,滴定结束时无气泡
B.锥形瓶装液前用待测液润洗
C.NaOH标准液保存时间过长,有部分Na2CO3生成
D.滴定终点时,俯视读数
(4)根据上表记录数据,通过计算可得该盐酸的浓度为0.1626 mol•L-1.
①量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液.
②用标准液滴定至终点,记录滴定管液面读数,所得数据如下表:
| 滴定次数 | 盐酸体积 | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
(1)步骤①中,量取20.00mL待测液应使用酸式滴定管(填仪器名称),若在锥形瓶装液前残留少量蒸馏水,将使测定结果无影响(填“偏大”、“偏小”或“无影响”).
(2)步骤②中,滴定时眼睛应注视锥形瓶(填仪器名称),判断到达滴定终点的依据是滴入最后一滴NaOH溶液,锥形瓶中溶液由无色变为浅红色,半分钟不变色.
(3)第一次滴定记录的NaOH溶液的体积明显多于后两次的体积,其可能的原因是AB(填字母)
A.滴定前滴定管尖嘴有气泡,滴定结束时无气泡
B.锥形瓶装液前用待测液润洗
C.NaOH标准液保存时间过长,有部分Na2CO3生成
D.滴定终点时,俯视读数
(4)根据上表记录数据,通过计算可得该盐酸的浓度为0.1626 mol•L-1.
6.居室内空气污染物的主要来源是人们使用的装饰材料、胶黏剂、内墙涂料等释放出来的一种有刺激性气味的气体.据此判断,下列说法不正确的是( )
| A. | 这种气体是甲醛 | |
| B. | 这种气体是苯 | |
| C. | 该气体可用新制氢氧化铜悬浊液进行检验 | |
| D. | 这种气体可使酸性高锰酸钾溶液褪色 |
13.下列说法中不正确的是( )
| A. | 不粘锅的内壁有聚四氟乙烯涂层,它不能使酸性高锰酸钾溶液褪色 | |
| B. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| D. | 淀粉和纤维素的组成都是(C6H10O5)n,两者互为同分异构体,且水解最终产物都是葡萄糖 |
7.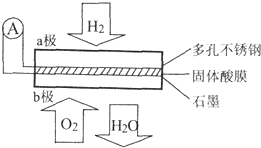 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )
 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )| A. | H+由b极通过固体酸电解质传递到a极 | |
| B. | b极上的电极反应式为:O2+4H++4e-=2H2O | |
| C. | 每转移0.4 mol电子,生成3.6g水 | |
| D. | 电池工作时,化学能主要转化为电能 |
8.下列相关关系正确的是( )
| A. | 热稳定性:H2O>HF>H2S | B. | 原子半径:Na>Mg>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 离子半径:Cl->S2->K+ |
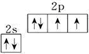 ,氧的第一电离能在同周期元素中由大到小排第4位.
,氧的第一电离能在同周期元素中由大到小排第4位.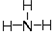 .
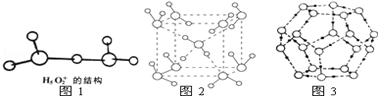
.
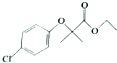 )是临床上一种降脂抗血栓药物,它的一条合成路线如下:
)是临床上一种降脂抗血栓药物,它的一条合成路线如下: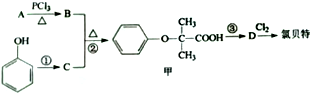

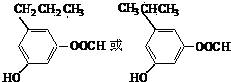 .
.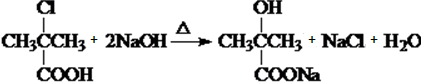 .
.