题目内容
4.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,22.4 L 酒精含有的分子数为NA | |
| B. | 500mL 1moL/L的盐酸中含有的HCl分子数为0.5 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积约为22.4 L | |
| D. | 通常状况下,71 g Cl2所含原子数为2 NA |
分析 A、酒精在标况下不是气体;
B、盐酸中不存在氯化氢分子;
C、根据公式N=nNA=$\frac{V}{Vm}$NA来计算;
D、根据公式N=nNA=$\frac{m}{M}$NA来计算.
解答 解:A、标准状况下,22.4 L 不是1mol,酒精含有的分子数不是NA,故A错误;
B、盐酸中不存在氯化氢分子,500mL 1moL/L的盐酸中含有的HCl分子数为0,故B错误;
C、通常状况下,NA 个CO2分子的物质的量是1mol,但是Vm不是22.4L/mol,即占有的体积不是22.4,故C错误;
D、根据N=nNA=$\frac{m}{M}$NA通常状况下,71 g Cl2所含原子数N=nNA=$\frac{m}{M}$NA=$\frac{71g}{71g/mol}×2$NA,故D正确.
故选D.
点评 本题考查学生物质的量和阿伏加德罗常数的应用知识,属于综合知识的考查,难度中等.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
15.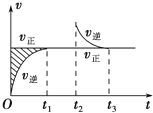 恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )
恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )
 恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )
恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )| A. | Z和W在该条件下有一种是为气态 | |
| B. | t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 | |
| C. | 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等 | |
| D. | 若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 |
12.下列说法中正确的是( )
| A. | 1 mol H2中含有6.02×1023个H | B. | 1 mol氧含有6.02×1023个O2 | ||
| C. | 1 mol CaCl2溶液里含有1 mol离子 | D. | 1 mol H+中含有H+数为NA |
9.在Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2的中,下列叙述正确的是( )
| A. | Fe2O3 是还原剂 | B. | CO是氧化剂 | ||
| C. | 氧化剂得到6mol电子 | D. | 还原剂失去8mol电子 |
16.下列表述正确的是( )
| A. | 醛基的结构简式-COH | B. | 聚丙烯的结构简式  | ||
| C. | 四氯化碳分子的电子式  | D. | 丙烷分子的球棍模型  |
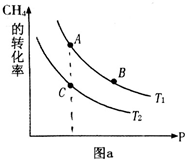 氢气、甲醇是优质的清洁燃料,可制作燃料电池.
氢气、甲醇是优质的清洁燃料,可制作燃料电池.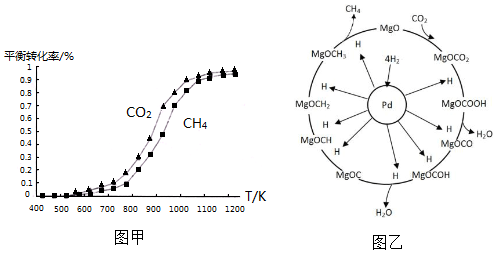 ①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应.
①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应. CH4+2H2O.
CH4+2H2O.