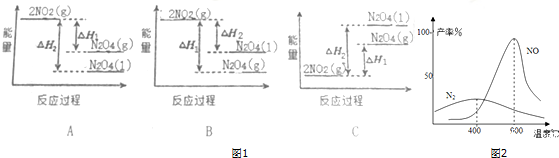
题目内容
9.在Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2的中,下列叙述正确的是( )| A. | Fe2O3 是还原剂 | B. | CO是氧化剂 | ||
| C. | 氧化剂得到6mol电子 | D. | 还原剂失去8mol电子 |
分析 反应Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,一氧化碳中C元素化合价升高失去电子为还原剂,氧化铁中Fe元素化合价降低得到电子为氧化剂,据此分析.
解答 解:A、在炼铁反应中Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,一氧化碳中C元素化合价升高失去电子为还原剂,故A错误;
B、在炼铁反应中Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,氧化铁中Fe元素化合价降低得到电子为氧化剂,故B错误;
C、在炼铁反应中Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,氧化铁中Fe元素化合价降低得到6mol电子,故C正确;
D、在炼铁反应中Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,一氧化碳中C元素化合价升高失去6mol电子,故D错误.
故选:C.
点评 本题难度不大,掌握一氧化碳还原氧化铁的反应原理、化合价变化是正确解答本题的关键.

练习册系列答案
相关题目
20.在温度相同、容积均为2L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是( )
(已知N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1)
| 甲 | 乙 | 丙 | |
| 反应物投入量 | 1moN2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
| NH3浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | 2p1=2p3>p2 | |
| B. | α2+α3<1 | |
| C. | 达到平衡时丙容器中NH3的体积分数最大 | |
| D. | Q1+Q3>92.4 |
17.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+═2As+3SnCl62-+6M,关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3 ②还原性:Cl->As ③M为OH- ④SnCl62-是氧化产物
⑤每生成7.5g As(As的相对原子质量为75),还原剂失去的电子为0.3mol.
①氧化剂是H3AsO3 ②还原性:Cl->As ③M为OH- ④SnCl62-是氧化产物
⑤每生成7.5g As(As的相对原子质量为75),还原剂失去的电子为0.3mol.
| A. | ①④⑤ | B. | ①③⑤ | C. | ①②③ | D. | ①②③④⑤ |
4.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L 酒精含有的分子数为NA | |
| B. | 500mL 1moL/L的盐酸中含有的HCl分子数为0.5 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积约为22.4 L | |
| D. | 通常状况下,71 g Cl2所含原子数为2 NA |
14.下列各组离子一定能大量共存的是( )
| A. | 在无色溶液中:NH4+、Fe2+、SO42-、CO32- | |
| B. | 在含大量Ba2+溶液中:NH4+、Na+、Cl-、CO32- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| D. | 在酸性的溶液中:K+、Fe2+、Cl-、CH3COO- |
1.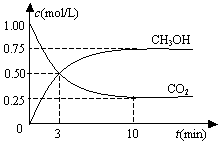 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
| A. | 反应进行到3 min时,该反应达到平衡状态 | |
| B. | 从反应开始到平衡,CO2的转化率为25% | |
| C. | 第3 min时,氢气的平均反应速率为1.5mol/(L•min) | |
| D. | 该温度下,反应的平衡常数的值为$\frac{16}{3}$ |
18.下列反应类型:①酯化、②取代、③消去、④加成、⑤水解、⑥还原,可能在有机物分子中引入羟基的是( )
| A. | ①②③⑥ | B. | ②④⑤⑥ | C. | ②④⑥ | D. | ②③④ |
19.在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.2kJ/mol,达到平衡后,为提高该反应的速率和CO的转化率,采取的正确措施是( )
| A. | 加催化剂同时升高温度 | B. | 升高温度同时充入N2 | ||
| C. | 加催化剂同时增大压强 | D. | 降低温度同时减小压强 |