题目内容
16.下列表述正确的是( )| A. | 醛基的结构简式-COH | B. | 聚丙烯的结构简式  | ||
| C. | 四氯化碳分子的电子式  | D. | 丙烷分子的球棍模型  |
分析 A.醛基的结构简式错误,应该为-CHO;
B.聚丙烯是丙烯中C=C双键中1个碳碳键断开自身加成反应生成高聚物,链节中主链为2个碳原子;
C.氯原子未成键的孤对电子对未画出;
D.丙烷分子中含有2个甲基和1个亚甲基,据此判断丙烷的球棍模型.
解答 解:A.醛基的结构简式为:-CHO,故A错误;
B.聚丙烯是丙烯中C=C双键中1个碳碳键断开自身加成反应生成高聚物,链节中主链为2个碳原子,聚丙烯的结构简式为 ,故B错误;
,故B错误;
C.氯原子未成键的孤对电子对未标出,四氯化碳正确的电子式为 ,故C错误;
,故C错误;
D.丙烷分子中含有2个甲基和1个亚甲基,其球棍模型为: ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、结构简式、球棍模型等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.甲醇是重要的化工原料,又可作为燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示.
请回答下列问题:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图1所示.
下列说法正确的是C(填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
(5)新型高效的甲醇燃料电池采用铂为电极材料,两电极上分别通入CH3OH和O2.
某研究小组将两个甲醇燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图2所示.回答下列问题:
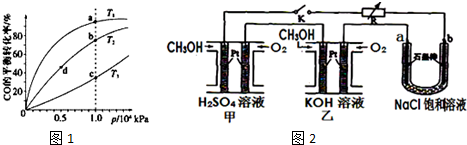
乙燃料电池的负极反应式为2CH3OH-12e-+16OH-=2CO32-+12H2O.
| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图1所示.
下列说法正确的是C(填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
(5)新型高效的甲醇燃料电池采用铂为电极材料,两电极上分别通入CH3OH和O2.
某研究小组将两个甲醇燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图2所示.回答下列问题:

乙燃料电池的负极反应式为2CH3OH-12e-+16OH-=2CO32-+12H2O.
7.用红色激光照射下列物质,能观察到丁达尔效应的是( )
| A. | 乙醇溶液 | B. | 氢氧化铁胶体 | C. | 硫酸铜溶液 | D. | 蔗糖溶液 |
4.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L 酒精含有的分子数为NA | |
| B. | 500mL 1moL/L的盐酸中含有的HCl分子数为0.5 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积约为22.4 L | |
| D. | 通常状况下,71 g Cl2所含原子数为2 NA |
11.下列实验操作中,正确的是( )
| A. | 利用过滤分离溶液和胶体 | |
| B. | 用渗析法可以除去溶液中的胶体粒子 | |
| C. | 向氢氧化钠溶液中边滴加饱和FeCl3溶液边振荡制备Fe(OH)3胶体 | |
| D. | 向Fe(OH)3胶体中加入足量稀盐酸后,依然有丁达尔效应 |
1.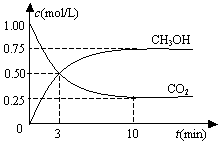 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
| A. | 反应进行到3 min时,该反应达到平衡状态 | |
| B. | 从反应开始到平衡,CO2的转化率为25% | |
| C. | 第3 min时,氢气的平均反应速率为1.5mol/(L•min) | |
| D. | 该温度下,反应的平衡常数的值为$\frac{16}{3}$ |
5.ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法不正确的是( )
| A. | KClO3发生还原反应 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | H2C2O4的氧化性强于ClO2的氧化性 | |
| D. | 每生成1 mol ClO2,转移的电子数约为6.02×1023 |
6.下列关于丙烯(CH3-CH=CH2)的说法正确的( )
| A. | 丙烯分子有7个σ键,1个π键 | |
| B. | 丙烯分子中的碳原子有sp3和sp2两种杂化类型 | |
| C. | 丙烯分子的所有原子共平面 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |