题目内容
19.已知aR2+微粒核外有b个电子,则N克该微粒所含的中子数为( )| A. | a-b+2 | B. | $\frac{N(a-b-2)}{a}$ | C. | $\frac{N(a-b+2)}{a}$ | D. | a-b-2 |
分析 质子数、中子数、核外电子数及其相互联系,中子数=相对原子质量-质子数,据此解题.
解答 解:R2-是得到2个电子后形成的,所以R原子的电子数为b-2,故R原子的质子数为b-2,则R原子的中子数=相对原子质量-质子数=a-b+2,N克该微粒所含的中子数为$\frac{N(a-b-2)}{a}$.
故选B.
点评 本题考查质子数、中子数、核外电子数及其相互联系,难度不大,明确粒子中粒子结构示意图的含义、核内质子数和核外电子数之间的关系是去解题的关键.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
9.下列事实不能用元素周期律解释的是( )
| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 酸性:H2CO3>H2SiO3 | ||
| C. | 碱性:NaOH>LiOH | D. | 热稳定性:HF>HBr |
10.下列实验不能达到实验目的是( )
| A. |  萃取时振荡分液漏斗 | B. |  电解精炼铜 | ||
| C. |  铝热反应 | D. |  实验室模拟合成氨 |
14.下列说法正确的是( )
| A. | 液态植物油通过催化加氢可制得人造奶油 | |
| B. | 饱和(NH4)2SO4溶液可使蛋白质变性 | |
| C. | 淀粉和蛋白质的组成元素相同 | |
| D. | 石蜡油经分馏可以获得乙烯 |
11.只用氢氧化钠溶液不能除去下列各组物质中的杂质(括号中是杂质)的是( )
| A. | Mg(OH)2[Al(OH)3] | B. | MgCl2(AlCl3) | C. | Mg(Al) | D. | MgO(Al2O3) |
8. (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
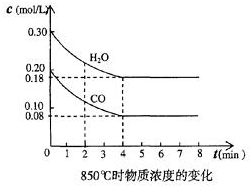
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)?CO2(g)十H2 (g)十Q(Q>0)
CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03 mol/(L•min)
t1时物质浓度(mol/L)的变化
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.
①表中3min~4min之间反应处于平衡状态;C1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min~5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min~6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)?CO2(g)十H2 (g)十Q(Q>0)
CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03 mol/(L•min)
t1时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.38 | 0.238 | 0.062 | 0.062 |
| 3 | c | c2 | c3 | c3 |
| 4 | c | c2 | c3 | c3 |
| 5 | 0.6 | 0.26 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中3min~4min之间反应处于平衡状态;C1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min~5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min~6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
9.能正确表示下列化学反应的离子方程式是( )
| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+═H2O | |
| B. | 往CaCl2溶液中通入少量的CO2 Ca2++CO2+H2O═CaCO3↓+2H+ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
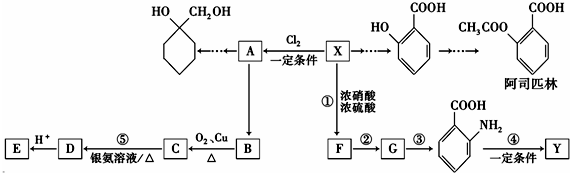
 (苯胺,易被氧化)
(苯胺,易被氧化)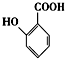 的名称为邻羟基苯甲酸,G中官能团名称为硝基、羧基;
的名称为邻羟基苯甲酸,G中官能团名称为硝基、羧基; ;
; $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +(n-1)H2O;
+(n-1)H2O;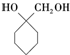 的合成路线(无机试剂任用).合成路线流程图示例如下:
的合成路线(无机试剂任用).合成路线流程图示例如下: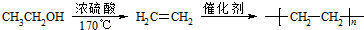
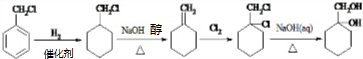 .
.