题目内容
11.只用氢氧化钠溶液不能除去下列各组物质中的杂质(括号中是杂质)的是( )| A. | Mg(OH)2[Al(OH)3] | B. | MgCl2(AlCl3) | C. | Mg(Al) | D. | MgO(Al2O3) |
分析 氯化镁、氯化铝均与NaOH反应,则只用氢氧化钠溶液不能除去杂质,以此来解答.
解答 解:A.Al(OH)3与NaOH溶液反应,而Mg(OH)2不能,则只用氢氧化钠溶液可除杂,故A正确;
B.二者均与均与NaOH反应,则只用氢氧化钠溶液不能除去杂质,还需要盐酸,故B错误;
C.Al与NaOH反应,而Mg不能,则只用氢氧化钠溶液可除杂,故C正确;
D.氧化铝与NaOH溶液反应,而MgO不能,则只用氢氧化钠溶液可除杂,故D正确.
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质及发生的反应为解答的关键,注意Al及其氧化物的性质及应用,题目难度不大.

练习册系列答案
相关题目
1.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),下列各项能说明反应达到平衡状态的是abc.
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变
d.每消耗1molO2同时生成2molNO2
(2)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)?CH3OH(g),达平衡后测得各组分浓度如下:
①列式并计算平衡常数K=$\frac{2}{3}$.
②若降低温度,K值增大,则反应的△H<0(填“>”或“<”).
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正=v逆(填“>”、“<”或“=”)
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),下列各项能说明反应达到平衡状态的是abc.
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变
d.每消耗1molO2同时生成2molNO2
(2)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)?CH3OH(g),达平衡后测得各组分浓度如下:
| 物质 | CO | H2 | CH3OH |
| 浓度(mol•L-1) | 0.9 | 1.0 | 0.6 |
②若降低温度,K值增大,则反应的△H<0(填“>”或“<”).
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正=v逆(填“>”、“<”或“=”)
19.已知aR2+微粒核外有b个电子,则N克该微粒所含的中子数为( )
| A. | a-b+2 | B. | $\frac{N(a-b-2)}{a}$ | C. | $\frac{N(a-b+2)}{a}$ | D. | a-b-2 |
6.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4 NH3.H20═Al02-+4NH4++2H20 | |
| B. | 澄清石灰水与足量小苏打溶液混合:Ca2++2OH-+2 HCO3-═CaC03+CO32-+2 H2O | |
| C. | 食醋腐蚀大理石面板:CaCO3+2 H+═Ca2++CO2+H2O | |
| D. | 少量钠投入硫酸铜溶液中:2Na+Cu2+═2 Na++Cu |
16.下列化学用语正确的是( )
| A. | H2O2的电子式 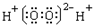 | |
| B. | 氨分子的结构式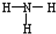 | |
| C. | S2-的结构示意图 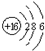 | |
| D. | 原子核内有20个中子的氯原子${\;}_{37}^{17}Cl$ |
20.在某无色透明的酸性溶液中,能共存的离子组是( )
| A. | NH4+、NO3-、Al3+、Cl- | B. | Na+、OH-、K+、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、SO42-、HCO3-、Na+ |

 .
.