题目内容
16. 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.(Ⅰ)(1)甲同学在a、b、c三只烧杯里分别加入50mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂块、钠块、钾块,观察现象.
甲同学设计该实验的目的是验证锂、钠、钾的活泼性(或同一主族,从上到下元素的金属性逐渐增强),
反应最剧烈的烧杯是C(填字母),结论是钾的活泼性最强.
(2)乙同学想验证同周期元素金属性强弱的规律,最好选用第三周期的钠、镁、铝三种元素.最简单的实验是将大小相近的三小块金属分别投入相同浓度的稀盐酸中,观察现象.应该看到的现象是:
①钠剧烈反应,可能着火或爆炸,
②镁反应较剧烈,产生大量气泡,
③铝反应比镁缓慢,有较多的气泡产生.
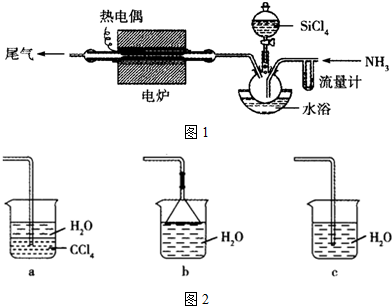
(Ⅱ)丙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证氮、碳、硅元素的非金属性强弱.
丙同学设计的实验可直接证明三种酸的酸性强弱,
已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成.
(1)写出所选用物质的化学式:A:HNO3,B:CaCO3,C:Na2SiO3.
(2)写出烧杯中所发生反应的离子方程式:CO2+SiO32-+H2O═H2SiO3↓+CO32-或2CO2+SiO32-+2H2O═H2SiO3↓+2HCO3-.
分析 (I)(1)由“研究性学习小组设计了一组实验验证元素周期律”可知,甲同学设计实验的目的是验证锂、钠、钾的金属性强弱;金属性越强,单质与水反应越剧烈;
(2)验证同周期元素金属性强弱的规律,最好选用第3周期的钠、镁、铝三种元素.因为与第2、4、5、6周期相比较,第3周期元素的变化规律较典型;
(II)利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,为硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠,以此解答.
解答 解:(1)由“研究性学习小组设计了一组实验验证元素周期律”可知,甲同学设计实验的目的是验证锂、钠、钾的金属性强弱;
金属性K>Na>Li,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是C;所以钾的活泼性最强;
故答案为:验证锂、钠、钾的活泼性(或同一主族,从上到下元素的金属性逐渐增强);C;钾的活泼性最强;
(2)验证同周期元素金属性强弱的规律,最好选用第三周期的钠、镁、铝三种元素.因为与第2、4、5、6周期相比较,第三周期元素的变化规律较典型;三种金属中钠最活泼,遇水就剧烈反应,与盐酸反应更剧烈,产生大量热,放出H2,可能会着火或爆炸,铝金属活动性最弱,与酸反应比镁要缓慢,但也能产生大量气泡,镁与酸剧烈反应,产生大量气泡;
故答案为:三;钠、镁、铝;①钠剧烈反应,可能着火或爆炸;②镁反应较剧烈,产生大量气泡;③铝反应比镁缓慢,有较多的气泡产生;
(Ⅱ)(1)乙同学的实验是利用强酸制弱酸的原理.非金属性越强,其最高价氧化物对应水化物的酸性越强.由题意可推测,A为HNO3,B为CaCO3,C为Na2SiO3或K2SiO3;烧杯中二氧化碳与硅酸钠反应生成硅酸沉淀,其反应离子方程式为:CO2+SiO32-+H2O═H2SiO3↓+CO32-或2CO2+SiO32-+2H2O═H2SiO3↓+2HCO3-,
故答案为:HNO3;CaCO3;Na2SiO3;
(2)发生的反应的离子方程式为:CO2+SiO32-+H2O═H2SiO3↓+CO32-或2CO2+SiO32-+2H2O═H2SiO3↓+2HCO3-;
故答案为:CO2+SiO32-+H2O═H2SiO3↓+CO32-或2CO2+SiO32-+2H2O═H2SiO3↓+2HCO3-.
点评 本题考查性质实验方案的设计,侧重于学生的分析能力和实验能力的考查,本题将元素及其化合物、元素周期律与实验知识结合起来,具有较强的综合性,难度不大.

| 实验 | 操作 | |
| A | 观察钠与水反应的现象 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 检验NaHCO3与Na2CO3溶液 | 用小试管分别取少量溶液,然后滴加澄清石灰水 |
| C | 证明Na2O2与CO2是放热反应 | Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应 |
| D | 检验Na2CO3与K2CO3溶液 | 用稀硫酸清洗过的铂丝分别蘸取溶液,在酒精灯外焰上灼烧,透过蓝色钴玻璃观察火焰的颜色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 80% | B. | 85% | C. | 90% | D. | 95% |
| A. | 1 mol CH3CH2CH2CH3分子储存的能量大于1 mol (CH3)2CHCH3分子 | |
| B. | 1 mol CH3CH2CH2CH3分子储存的能量小于1 mol (CH3)2CHCH3分子 | |
| C. | (CH3)2CHCH3转化为CH3CH2CH2CH3的过程是一个放热过程 | |
| D. | 断开1 mol物质中化学键吸收的能量CH3CH2CH2CH3大于(CH3)2CHCH3 |
| A. | 7.8 g Na2O2中所含阴离子的数目是0.2NA | |
| B. | 标准状况下,22.4 L SO3含分子数为NA | |
| C. | 标准状况下,2.24 L 18O2中所含中子的数目是2NA | |
| D. | 用足量NaOH溶液完全吸收1 mol Cl2时,转移电子的数目是2NA |
| A. | 苯、乙酸、四氯化碳 | B. | 苯、乙醇、冰醋酸 | ||
| C. | 硝基苯、乙醇、四氯化碳 | D. | 硝基苯、乙醇、乙酸 |
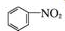 +SnCl2$\stackrel{HCl}{→}$
+SnCl2$\stackrel{HCl}{→}$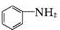 +SnCl4
+SnCl4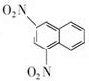 .
.