题目内容
8.硫酸在下列用途或反应中各表现的性质是:A、强酸性 B、难挥发性 C、吸水性D、脱水性 E、强氧化性
(1)实验室制CO2气体A;
(2)干燥H2、SO2等气体C;
(3)用铝槽车装运浓硫酸E;
(4)清洗镀件表面氧化物A;
(5)浓硫酸使湿润石蕊试纸变红,后来又变黑AD.
分析 (1)硫酸的酸性强于碳酸,应用强酸制弱酸;
(2)浓硫酸的吸水性,干燥H2、SO2等气体;
(3)铝与浓硫酸发生钝化,用铝槽车装运浓硫酸;
(4)清洗镀件表面氧化物与硫酸发生复分解反应,体现硫酸的强酸性;
(5)浓硫酸使湿润石蕊试纸变红,体现硫酸的酸性,后来又变黑,体现脱水性.
解答 解:(1)硫酸的酸性强于碳酸,应用强酸制弱酸,所以硫酸的强酸性,故选:A;
(2)浓硫酸的吸水性,干燥H2、SO2等气体,故选:C;
(3)铝与浓硫酸发生钝化,用铝槽车装运浓硫酸,体现硫酸的强氧化性,故选:E;
(4)清洗镀件表面氧化物与硫酸发生复分解反应,体现硫酸的强酸性,故选:A;
(5)浓硫酸使湿润石蕊试纸变红,体现硫酸的酸性,后来又变黑,体现脱水性,所以既体现强酸性又体现强氧化性,故选:AD.
点评 本题考查浓硫酸的性质,熟悉浓硫酸有吸水性、脱水性、强氧化性是解答的关键,明确钝化发生氧化还原反应,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.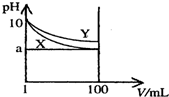 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | Y碱溶液稀释过程中溶液中c(H+)减小 | |
| B. | 稀释后,X溶液的碱性比Y溶液的碱性弱 | |
| C. | 分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积VX>VY | |
| D. | 若8<a<10,则X、Y都是弱碱 |
19.将Mg和Cu组成的混合物7.64g投入足量的稀硝酸中使其完全反应,得到的唯一还原产物NO在标准状况下体积为2.24L.将反应后的溶液稀释为1L,测得溶液的pH=1,此时溶液中NO3-的浓度为( )
| A. | 0.3 mol/L | B. | 0.4 mol/L | C. | 0.5 mol/L | D. | 0.6 mol/L |
17.光纤通信是一种现代化的通信手段,制造光导纤维的主要原料是SiO2,下列关于SiO2的说法正确的是( )
| A. | SiO2的摩尔质量是60 | |
| B. | 1mol SiO2中含有1mol O2 | |
| C. | 1.5mol SiO2中含有1.806×1024个氧原子 | |
| D. | 1mol SiO2的质量是60g•mol-1 |
 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律. (1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)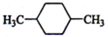 B、
B、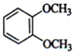 C、
C、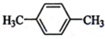 D、CH3CH2CH2CH3
D、CH3CH2CH2CH3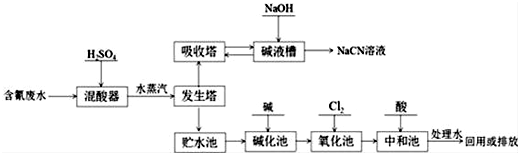
 .
. 已知A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素.其中A、B、C是同一周期的非金属元素.D与C可以形成两种常见的离子晶体,D的阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物M,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素.其中A、B、C是同一周期的非金属元素.D与C可以形成两种常见的离子晶体,D的阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物M,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)