题目内容
1.氮化硅是一种重要的结构陶瓷材料,实验室可依据反应3SiCl4+4NH3$\frac{\underline{\;1000℃\;}}{\;}$Si3N4+12HCl模拟工业制备氮化硅.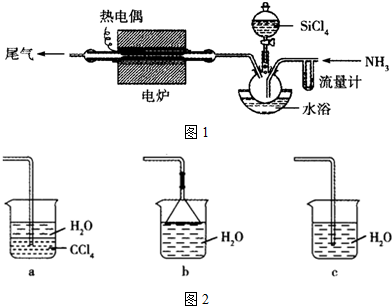
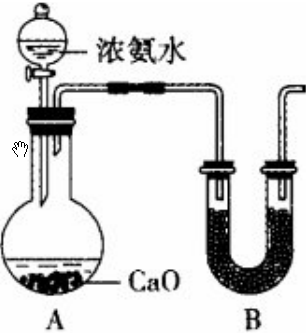
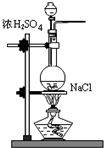
(1)甲组同学依据下列装置制备NH3;
①圆底烧瓶中发生反应的化学方程式为CaO+NH3•H2O=Ca(OH)2+NH3↑.
②B中盛放的试剂为碱石灰.
(2)乙组同学拟利用甲组的A、B装置及下列装置如图1合成氮化硅:
①实验中必须控制氨气的流量,氨气过多,在尾气口可观察到的现象是有白烟产生.
②已知SiCl4的沸点为57.6℃,水浴加热温度控制在稍高于57.6℃的好处是既能使SiCl4沸腾,又能防止温度过高导致利用率降低.
③尾气的吸收装置如图2可选择ab(填字母).
(3)丙组同学拟设计实验证明下列物质的性质,请写出设计方案的要点.
①四氯化硅常温下极易水解在盛水的烧杯中滴入几滴四氯化硅,观察到有白雾产生或有白色沉淀产生.
②氮化硅能溶于氢氟酸不溶于硫酸在一支普通试管中加入少量Si3N4,向其中滴入硫酸,观察到固体不溶解,在另一支塑料试管中加入少量Si3N4,向其中滴入氢氟酸,观察到固体溶解.
分析 本题是利用氧化钙和氨水制得的少量氨气经碱石灰干燥后,将生成的氨气和SiCl4一起在高温下发生反应:3SiCl4+4NH3$\frac{\underline{\;1000℃\;}}{\;}$Si3N4+12HCl,可制得Si3N4,因氯化氢极易溶解于水,含氯化氢的尾气处理时要选择防倒吸装置,据此分析解题;
(1)①CaO可水反应生成氢氧化钙,同时放热,促进氨气挥发,利用此原理可制得少量氨气;
②氨气的水溶液显碱性,易与酸反应生成盐,则干燥氨气通常选择碱性固体;
(2)①反应中生成氯化氢,过量的氨气遇氯化氢现象是白烟;
②水浴加热的好处是易控制温度,避免温度过高四氯化硅气流速度过快,反应不充分,反应物利用率降低;
③反应尾气主要是氯化氢气体,此气体极遏易溶解于水,选择的尾气处理装置应有防倒吸功能;
(3)①四氯化硅极易水解,水解产物为氯化氢和硅酸,可根据水解产物设计并判断;
②可在盛放少量氮化硅的容器中分别滴加氢氟酸和硫酸,根据现象判断即可,特别注意氢氟酸能腐蚀玻璃,因此滴加氢氟酸的容器只能要塑料容器,不能用玻璃烧杯或试管.
解答 解:本题是利用氧化钙和氨水制得的少量氨气经碱石灰干燥后,将生成的氨气和SiCl4一起在高温下发生反应:3SiCl4+4NH3$\frac{\underline{\;1000℃\;}}{\;}$Si3N4+12HCl,可制得Si3N4,因氯化氢极易溶解于水,含氯化氢的尾气处理时要选择防倒吸装置,据此分析解题;
(1)①利用氧化钙和氨水反应制少量氨气,发生反应的化学方程式为CaO+NH3•H2O=Ca(OH)2+NH3↑,故答案为:CaO+NH3•H2O=Ca(OH)2+NH3↑;②氨气的干燥通常选择碱石灰,故答案为:碱石灰;
(2)①在生成氮化硅的同时得到副产物氯化氢,过量氨气和氯化氢反应生成氯化铵,现象是有白烟产生,故答案为:有白烟产生;
①为既能使SiCl4沸腾,又能防止温度过高导致利用率降低通常使用水浴加热的方式,故答案为:既能使SiCl4沸腾,又能防止温度过高导致利用率降低;
②可供选择的尾气处理装置,其中a、b有防倒吸功能,可用来吸收含有氯化氢的尾气,故答案为:ab;
(3)①在盛水的烧杯中滴入几滴四氯化硅,观察到有白雾产生或有白色沉淀产生由此可推断四氯化硅极易水解,故答案为:在盛水的烧杯中滴入几滴四氯化硅,观察到有白雾产生可有白色沉淀产生;
②为难氮化硅能否溶解于氢氟酸和硫酸,同时结合氢氟酸能腐蚀玻璃的特性,可在一支普通试管中加入少量Si3N4,向其中滴入硫酸,观察到固体不溶解,在另一支塑料试管中加入少量Si3N4,向其中滴入氢氟酸,观察到固体溶解;故答案为:在一支普通试管中加入少量Si3N4,向其中滴入硫酸,观察到固体不溶解,在另一支塑料试管中加入少量Si3N4,向其中滴入氢氟酸,观察到固体溶解.
点评 本题以制备氮化硅为载体,考查实验的设计与评价,涉及氨气的制取与干燥、氯化氢气体的溶解及四氯化硅的水解等,属基础考查,难度适中,建议重视实验的基本操作和反应原理的复习.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案| A. | SiO2的摩尔质量是60 | |
| B. | 1mol SiO2中含有1mol O2 | |
| C. | 1.5mol SiO2中含有1.806×1024个氧原子 | |
| D. | 1mol SiO2的质量是60g•mol-1 |
| A. | NaAl(SO4)2溶液中滴加Ba(OH)2直至SO42-沉淀完全:2Al3++6OH-+3SO42-+3Ba2+=2Al(OH)3↓+3BaSO4↓ | |
| B. | NH4HS溶液与少量的NaOH溶液反应:NH4++OH-=NH3•H2O | |
| C. | 稀H2SO4和Na2S2O3溶液共热:S2O32-+2H+$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+S↓+H2O | |
| D. | 过量Cl2通入Fel2溶液中:3Cl2+2I-+4Fe2+=4Cl-+I2+4Fe3+ |
| A. | 小于2:7 | B. | 等于2:7 | C. | 大于2:7 | D. | 无法肯定 |
| A. | 盐酸 | B. | 稀硝酸 | C. | 乙酸 | D. | 乙醇 |
| A. | 只有① | B. | 只有①② | C. | 只有②③ | D. | ①②③④ |
| 实验序号 | a | b | c |
| 合金质量(g) | 0.51 | 0.765 | 0.918 |
| 气体体积(mL) | 560 | 672 | 672 |
(2)合金中镁的质量分数为47%(保留2位有效数字).
 (3)向c组试验后的容器中加入78mL 1.0mol/L的氢氧化钠溶液,可恰好使剩余合金中的铝完全溶解.
(3)向c组试验后的容器中加入78mL 1.0mol/L的氢氧化钠溶液,可恰好使剩余合金中的铝完全溶解.Ⅱ、铝电池性能优越,铝-空气电池因环保、安全而受到越来越多的关注,其原理如图所示.
(1)该电池的总反应的化学方程式为4Al+3O2+6H2O=4Al(OH)3.
(2)电池中NaCl的作用是增强溶液导电能力.
(3)以该电池电解KI溶液制取KIO3(以石墨为电极材料)时,电解过程中阳极的电极反应为I-+3H2O-6e-=IO3-+6H+.
 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.