题目内容
5.有机物F在有机药物合成中有广泛应用,F可通过下列线路合成.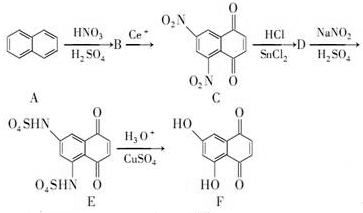
已知:
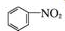 +SnCl2$\stackrel{HCl}{→}$
+SnCl2$\stackrel{HCl}{→}$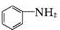 +SnCl4
+SnCl4请回答下列问题:
(1)化合物B的结构简式是
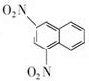 .
.(2)A→B的反应类型是取代反应.
分析 (1)A发生硝化反应生成B,由C可知B含有2个硝基;
(2)A→B的反应类型为硝化反应,也为取代反应.
解答 解:(1)A发生硝化反应生成B,由C可知B含有2个硝基,B的结构简式为 ,故答案为:
,故答案为: ;
;
(2)A→B的反应类型为硝化反应,也为取代反应,故答案为:取代反应.
点评 本题考查有机物的合成,为高频考点,侧重于学生的分析能力的考查,解答本题的关键是能正确把握有机物官能团的性质,注意根据官能团的转化判断反应类型,题目难度不大.

练习册系列答案
相关题目
15.溶液体积和pH都相同的一元强酸X与一元弱酸溶液Y,已知弱酸的电离度为0.5%,则X和Y溶液分别中和相同浓度的NaOH溶液时,所需Y溶液的体积是X溶液的( )
| A. | 20倍 | B. | 100倍 | C. | 200倍 | D. | 500倍 |
10.下列有关说法正确的是( )
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,向0.1 mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中的$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$值增大到原来的10倍 | |
| D. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) |
17.光纤通信是一种现代化的通信手段,制造光导纤维的主要原料是SiO2,下列关于SiO2的说法正确的是( )
| A. | SiO2的摩尔质量是60 | |
| B. | 1mol SiO2中含有1mol O2 | |
| C. | 1.5mol SiO2中含有1.806×1024个氧原子 | |
| D. | 1mol SiO2的质量是60g•mol-1 |
14.下列离子方程式书写正确的是( )
| A. | NaAl(SO4)2溶液中滴加Ba(OH)2直至SO42-沉淀完全:2Al3++6OH-+3SO42-+3Ba2+=2Al(OH)3↓+3BaSO4↓ | |
| B. | NH4HS溶液与少量的NaOH溶液反应:NH4++OH-=NH3•H2O | |
| C. | 稀H2SO4和Na2S2O3溶液共热:S2O32-+2H+$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+S↓+H2O | |
| D. | 过量Cl2通入Fel2溶液中:3Cl2+2I-+4Fe2+=4Cl-+I2+4Fe3+ |
10.Ⅰ、取不同质量的某镁铝合金样品分别和30mL同浓度的盐酸反应,所取合金质量与产生气体的体积(已换算为标准状况)如表所示:
(1)盐酸的物质的量浓度为2mol/L.
(2)合金中镁的质量分数为47%(保留2位有效数字).
 (3)向c组试验后的容器中加入78mL 1.0mol/L的氢氧化钠溶液,可恰好使剩余合金中的铝完全溶解.
(3)向c组试验后的容器中加入78mL 1.0mol/L的氢氧化钠溶液,可恰好使剩余合金中的铝完全溶解.
Ⅱ、铝电池性能优越,铝-空气电池因环保、安全而受到越来越多的关注,其原理如图所示.
(1)该电池的总反应的化学方程式为4Al+3O2+6H2O=4Al(OH)3.
(2)电池中NaCl的作用是增强溶液导电能力.
(3)以该电池电解KI溶液制取KIO3(以石墨为电极材料)时,电解过程中阳极的电极反应为I-+3H2O-6e-=IO3-+6H+.
| 实验序号 | a | b | c |
| 合金质量(g) | 0.51 | 0.765 | 0.918 |
| 气体体积(mL) | 560 | 672 | 672 |
(2)合金中镁的质量分数为47%(保留2位有效数字).
 (3)向c组试验后的容器中加入78mL 1.0mol/L的氢氧化钠溶液,可恰好使剩余合金中的铝完全溶解.
(3)向c组试验后的容器中加入78mL 1.0mol/L的氢氧化钠溶液,可恰好使剩余合金中的铝完全溶解.Ⅱ、铝电池性能优越,铝-空气电池因环保、安全而受到越来越多的关注,其原理如图所示.
(1)该电池的总反应的化学方程式为4Al+3O2+6H2O=4Al(OH)3.
(2)电池中NaCl的作用是增强溶液导电能力.
(3)以该电池电解KI溶液制取KIO3(以石墨为电极材料)时,电解过程中阳极的电极反应为I-+3H2O-6e-=IO3-+6H+.
 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.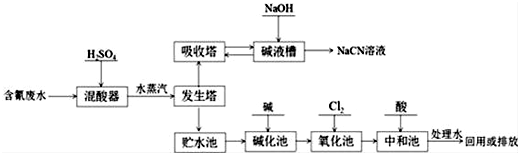
 .
.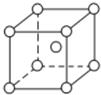 已知A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素.其中A、B、C是同一周期的非金属元素.D与C可以形成两种常见的离子晶体,D的阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物M,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素.其中A、B、C是同一周期的非金属元素.D与C可以形成两种常见的离子晶体,D的阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物M,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)