题目内容
4. 根据以下有关信息确定有机物的组成
根据以下有关信息确定有机物的组成(1)相对分子质量为72且沸点最低的烷烃的名称为C(CH3)4;
(2)C4H9Cl的核磁共振氢谱表明其只有一种化学环境的氢,则A的结构简式为(CH3)3CCl.
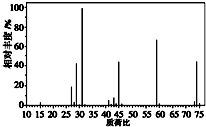
(3)如图是某有机物的质谱图,则其相对分子质量为74,若该有机物含有一个氧原子,其分子式为C4H10O.
(4)已知:
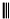 +
+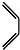 $\stackrel{△}{→}$
$\stackrel{△}{→}$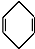 如果要合成
如果要合成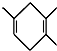 ,所用的起始原料的结构简式为C(CH3)2=C(CH3)2、CH3C≡CH或CH2=C(CH3)-CH=CH2、CH3C≡CCH3.
,所用的起始原料的结构简式为C(CH3)2=C(CH3)2、CH3C≡CH或CH2=C(CH3)-CH=CH2、CH3C≡CCH3.
分析 (1)根据烷烃通式确定该烷烃中碳原子个数,烷烃的同分异构体中,支链越多,其沸点越低;
(2)A的分子式为C4H9Cl,核磁共振氢谱表明其只有一种化学环境的氢,说明H原子相同,应为3个甲基连接在同一个C原子上;
(3)根据质谱图可知,该有机物的相对分子质量为74,若该有机物含有一个氧原子,分子式可能为C4H10O;
(4)根据1,3-丁二烯与乙炔反应: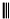 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$ 知,1,3-丁二烯中的两个碳碳双键断裂,中间形成一个碳碳双键,边上两个半键与乙炔中的两个半键相连构成环状,类比1,3-丁二烯与乙炔的加成反应,采用逆合成分析法可知,要合成
知,1,3-丁二烯中的两个碳碳双键断裂,中间形成一个碳碳双键,边上两个半键与乙炔中的两个半键相连构成环状,类比1,3-丁二烯与乙炔的加成反应,采用逆合成分析法可知,要合成 ,逆向推断
,逆向推断 或者是
或者是 .
.
解答 解:(1)设该烷烃中碳原子个数是n,通式为CnH2n+2,14n+2=72,n=5,所以该烷烃是戊烷,烷烃的同分异构体中,支链越多,其沸点越低,所以相对分子质量为72且沸点最低的烷烃的结构简式C(CH3)4,故答案为:C(CH3)4;
(2)A的分子式为C4H9Cl,核磁共振氢谱表明其只有一种化学环境的氢,则A为(CH3)3CCl,故答案为:(CH3)3CCl;
(3)根据质谱图可知,该有机物的相对分子质量为74,若该有机物含有一个氧原子,则剩余式量为74-16=58,分子式可能为C4H10O,故答案为:74;C4H10O;
(4)根据1,3-丁二烯与乙炔反应 知,1,3-丁二烯中的两个碳碳双键断裂,中间形成一个碳碳双键,边上两个半键与乙炔中的两个半键相连构成环状,类比1,3-丁二烯与乙炔的加成反应,采用逆合成分析法可知,要合成
知,1,3-丁二烯中的两个碳碳双键断裂,中间形成一个碳碳双键,边上两个半键与乙炔中的两个半键相连构成环状,类比1,3-丁二烯与乙炔的加成反应,采用逆合成分析法可知,要合成 ,逆向推断
,逆向推断 或者是
或者是 ,若为
,若为 ,则有机物的命名原则两种原料分别是2,3-二甲基-l,3-丁二烯和丙炔,结构简式分别为C(CH3)2=C(CH3)2、CH3C≡CH;
,则有机物的命名原则两种原料分别是2,3-二甲基-l,3-丁二烯和丙炔,结构简式分别为C(CH3)2=C(CH3)2、CH3C≡CH;
若为 ,则两种原料分别为2-甲基-l,3-丁二烯和2-丁炔,结构简式分别为CH2=C(CH3)-CH=CH2、CH3C≡CCH3,
,则两种原料分别为2-甲基-l,3-丁二烯和2-丁炔,结构简式分别为CH2=C(CH3)-CH=CH2、CH3C≡CCH3,
故答案为:C(CH3)2=C(CH3)2、CH3C≡CH或CH2=C(CH3)-CH=CH2、CH3C≡CCH3.
点评 本题考查了有机物实验式、分子式的确定,题目难度中等,注意掌握有机物分子式的计算方法,明确质谱图的含义,能够根据质谱图判断物质的相对分子量.

| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | 残留物只有Na2CO3 | |
| B. | 原混合气体中O2与CH4的物质的量之比为1﹕2 | |
| C. | 残留物只有NaOH | |
| D. | 原混合气体中O2和CH4的体积比为2﹕1 |
| A. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| B. | Z和Q形成的化合物为离子化合物 | |
| C. | 不存在由元素Z与元素W形成的化合物的水溶液 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
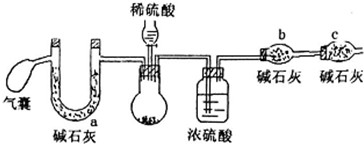
方案一:取m1g样品,加入足量的CaCl2溶液,充分反应后过滤、洗涤、干燥,测得CaCO3沉淀质量为m2g
方案二:取m1g样品,用如下装置测得生成二氧化碳的质量m3g
方案三:取m1g样品,加水充分溶解并微热至不再产生气体,用c mol•L-1的盐酸标准溶液滴定所得溶液(甲基橙作指示剂),终点时消耗盐酸的体积为V mL
回答下列问题:(1)方案一中,经正确操作后,测得的过氧化钠的纯度比实际的偏低,其原因是生成微溶的Ca(OH)2,致使m2数值偏大.
(2)方案二中,气囊要使用两次,第二次使用的目的是排出装置中生成的CO2完全被碱石灰吸收.
C干燥管的作用是防止空气中水和二氧化碳进入b中,若用稀盐酸代替稀硫酸,则测定结果偏低(填“高”、“低”、“不影响”)
(3)方案三中,滴定终点的现象是溶液由黄色变成橙色,且半分钟内不变黄,测得过氧化钠的纯度为$\frac{39(0.053Vc-{m}_{1})}{14{m}_{1}}$×100%(用含m1、c、V的式子表示)
(4)某小组同学向过氧化钠与水反应后的溶液中滴加酚酞,发现溶液先变红后褪色,针对导致溶液褪色的原因提出两种假设:
假设一:因氢氧化钠溶液的浓度过大而使溶液褪色
假设二:因生成了过氧化氢而使溶液褪色
实验验证:向等体积浓度分别为5mol•L-1,2mol•L-1,0.01mol•L-1的氢氧化钠溶液中滴加2滴酚酞试液,观察到溶液变红后褪色的时间如下:
| 氢氧化钠浓度(mol•L-1) | 5 | 2 | 1 | 0.01 |
| 溶液变红后褪色的时间(s) | 8 | 94 | 450 | 长时间不褪色 |
设计实验验证假设二:取两份等量的反应液于试管中,向其中一支试管加入少量二氧化锰并微热,滴几滴酚酞,溶液变红且不褪色,另一支试管中直接加入几滴酚酞,溶液变红后又褪色,说明假设二成立.
 SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
(2)吸收液吸收SO2的过程中,pH随n(SO32-),n(HSO3-)变化关系如表:
| n(SO32-):,n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab
a.c(Na-)=2c(SO3-)+c(HSO32-)
b.c(Na-)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(3)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如下:
①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理:氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
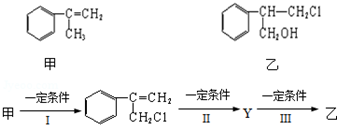
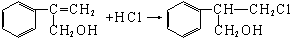 .
.